Поговорим о твердых телах. Твердые тела можно разделить на две большие группы: аморфные и кристаллические. Разделять мы их будем по принципу есть порядок или нет.
В аморфных веществах молекулы располагаются хаотично. В их пространственном расположении нет никаких закономерностей. По сути, аморфные вещества – это очень вязкие жидкости, настолько вязкие, что твердые.
Отсюда и название: «а-» – отрицательная частица, «morphe» – форма. К аморфным веществам относятся: стекла, смолы, воск, парафин, мыло.
Отсутствие порядка в расположении частиц обусловливает физические свойства аморфных тел: они не имеют фиксированных температур плавления. По мере нагревания их вязкость постепенно снижается, и они также постепенно переходят в жидкое состояние.
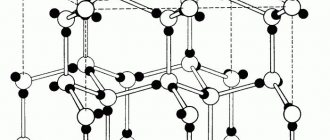
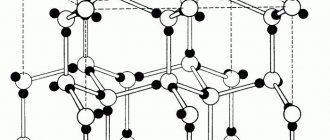
В противоположность аморфным веществам существуют кристаллические. Частицы кристаллического вещества пространственно упорядочены. Это правильная структура пространственного расположения частиц в кристаллическом веществе называется кристаллической решеткой.
В отличии от аморфных тел, кристаллические вещества имеют фиксированные температуры плавления.
В зависимости от того какие частицы находятся в узлах решетки, и от того какие связи удерживают их различают: молекулярную, атомную, ионную и металлическую решетки.
Для чего принципиально важно знать, какая у вещества кристаллическая решетка? Что она определяет? Все. Структура определяет, как химические и физические свойства вещества.
Самый простой пример: ДНК. У всех организмов на земле она построена из одинакового набора структурных компонентов: нуклеотидов четырех видов. А какое многообразие жизни. Это все определяется структурой: порядком, в котором эти нуклеотиды расположены.
Определение
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Семь типов кристаллических решеток
Есть семь разных кристаллических систем. Они были обнаружены в 1781 году отцом Рене Джаст Хауи. Он случайно заметил, что некоторые камни имеют идеальную форму. После многих лет исследований он разработал свою теорию о структуре кристаллов. В 1848 году Огюст Браве показывает, что может быть только семь типов элементарной кристаллической сетки.
Системы характеризуют различные геометрические формы, которые может иметь кристаллическая сетка.
Каждая из этих систем определяется своими осями: три размерных параметра (длина осей) и три угловых параметра (углы, образованные двумя осями). Условно мы называем abc длинами осей и α β и γ углами, образованными осями. Они размещены в пространстве следующим образом:
Каждая ячейка, представляющая систему, также имеет определенное количество симметрий. Эти симметрии бывают трех типов:
- центральный (отмечен С): точка является центром симметрии сетки;
- плоскости (отмечено P): плоскость является плоскостью симметрии сетки;
- осевой (О): поворот на определенный угол вокруг оси симметрии возвращает сетку в положение, идентичное исходному.
Эти симметрии имеют четыре порядка:
- двоичные ( обозначено L 2 ): вращение на 180 ° (π рад)
- троичное (обозначено L 3 ): вращение на 120 ° (2π/3 рад)
- четвертичное (отмечено L 4 ): Вращение на 90 ° (π/2 рад.)
- гексагональное (отмечено L 6 ): вращение на 60 ° (π/3 рад.)
Кубическая (или изометрическая) решетка
| a = b = c: три оси имеют одинаковую длину α = β = γ= 90 °: три угла равны и прямые Симметрии: C, 3 L 4 , 4 L 3, 6L 2, 9 P Базовый элемент — это куб. |
Квадратичная (или тетрагональная) решетка
| a = b ≠ c: две оси имеют одинаковую длину, а третья ось различается. α = β = γ= 90 °: три угла равны и прямые Симметрии: C, L 4 , 4L2, 5 P Основным элементом является правая призма с квадратным основанием. |
Орторомбическая кристаллическая решетка
| a ≠ b ≠ c: три оси имеют разную длину α = β = γ= 90 °: три угла равны и прямые Симметрии: C, 3 L 2, 3 P Основной элемент — прямоугольный параллелепипед. |
Моноклинная решетка
| a≠b≠c : три оси имеют неравную длину. β = γ= 90 °≠α: два угла равны и прямые. Симметрии: C, L 2 , P Основным элементом является наклонная призма, в основании которой ромб. |
Триклинная решетка
| a≠b≠c: три оси имеют неравную длину. α≠β ≠ γ≠ 90 °: три угла разные. Симметрии: C, L 2 , P Основной элемент — это параллелепипед с основанием ромб. |
Ромбоэдрическая решетка
| a = b = c: три оси имеют одинаковую длину α = β = γ≠ 90 °: три угла равны и прямые Симметрии: C, L 3 , 3 L 2 , P Основным элементом является параллелепипед все плоскости которого — ромбы. |
Виды решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
Металлическаякристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Ионный тип
Противоположно заряженные ионы находятся на узлах, которые создают электромагнитное поле, характеризующее физические свойства вещества. К таковым будут относиться: электропроводность, тугоплавкость, плотность и твёрдость. Поваренная соль и нитрат калия характеризуются наличием ионной кристаллической решётки.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Атомная решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).
Металлическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Ковалентные кристаллы
В узлах таких кристаллических решеток содержатся отдельные атомы или молекулы, соединенные между собой ковалентными связями.
Ковалентная связь представляет собой химическую связь, которая включает разделение пар электронов между атомами. Это разделение приводит к стабильному балансу сил притяжения и отталкивания между этими атомами. Ковалентные твердые вещества представляют собой класс соединений с расширенными решетками, в которых каждый атом или молекула ковалентно связаны с ближайшими соседями. Это означает, что весь кристалл, по сути, является одной гигантской молекулой. Чрезвычайно сильные связывающие силы, которые соединяют все смежные атомы, объясняют экстремальную твердость этих твердых тел. Они не могут быть разрушены или истерты без разрушения большого количества ковалентных химических связей. Точно так же ковалентное твердое вещество не может «расплавиться» в обычном смысле, так как весь кристалл является одной гигантской молекулой. При нагревании до очень высоких температур эти твердые вещества обычно разлагаются на их элементы.
Другим свойством ковалентных твердых тел является плохая электропроводность, поскольку делокализованных электронов в таких веществах нет. В случае расплавления, в отличие от ионных соединений, такие вещества также неспособны проводить электричество, так как их макромолекулы состоят из незаряженных атомов, а не ионов.
Теперь, зная вид химической связи в веществе, можно охарактеризовать не только ее количественный и качественный состав, но и физические свойства.
Видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Различные вещества
- Алмаз. Минерал обладает высокой ценностью и после огранки используется в ювелирных украшениях. Так в чём же заключается секрет популярности этого камня? Атомы углерода составляют основу всей решётки. Между атомами минерала существует прочная ковалентная связь. Для кристаллической решётки алмаза характерно плотное содержание атомов в виде куба. Другими словами, узлами считаются атомы углерода, а своеобразными гранями куба являются прочные ковалентные связи. Такой минерал считается самым прочным на планете, и неизвестно, сколько таких своеобразных кубов включает в себя цельный алмаз.
- Графит. Углерод также может быть и в другой кристаллической модификации. Атомная решётка данного элемента включает в себя только атомы углерода, ей присуща слоистая структура. В графите каждый атом связан тремя атомами углерода. Из-за этого он обладает металлическим блеском, высокой теплопроводностью.
- Кристаллическая решётка йода имеет молекулярный тип. Атомы молекул соединяются ковалентными связями, но молекулы химического элемента имеют слабые силы притяжения. Это характеризует йод тем, что он имеет малую твёрдость, низкую температуру плавления.
- Натрий. Представитель металлической кристаллической решётки. Между катионами, расположенными в узлах решётки, двигаются электроны. Они, присоединяясь к катионам, нейтрализуют их заряд, в свою очередь, нейтральные атомы отпускают часть электронов, преобразуясь в катионы. Такой тип кристаллической решётки наделяет металл пластичностью, электро- и теплопроводностью.
- Сухой лёд. Или оксид углерода в затвердевшем виде. Имеет молекулярную кристаллическую решётку в форме куба. Молекулы удерживаются между собой слабыми связями. иффузия читайте в нашей статье.
Это интересно: как определить валентность по таблице Менделеева?
Энергетический уровень
Отличия неметаллов и металлов первоначально обусловлены строением их атомов. Начнем с количества электронов на внешнем энергетическом уровне. У атомов металлов оно варьирует от одного до трех. Как правило, они обладают большим радиусом, поэтому атомы металлов достаточно легко отдают наружные электроны, так как имеют сильные восстановительные свойства.
У неметаллов число электронов на внешнем уровне больше. Это объясняет их окислительную активность. Неметаллы присоединяют недостающие электроны, полностью заполняя энергетический уровень. Самые сильные окислительные свойства проявляют неметаллы второго и третьего периода VI-VII групп.
Заполненный энергетический уровень содержит 8 электронов. Самой большой окислительной способностью обладают галогены с валентностью I. Среди них лидирует фтор, так как у этого элемента нет свободных орбиталей.
Что такое полуметаллы
В периодической таблице между металлами и неметаллами находится ряд химических элементов, которые занимают промежуточное положение. Их называют полуметаллами. Атомы полуметаллов связаны ковалентной химической связью.
Эти вещества совмещают признаки металлов и неметаллов. К примеру, сурьма является кристаллическим веществом серебристо-белого цвета и вступает в реакцию с кислотами, образуя соли — типичные металлические свойства. С другой стороны, сурьма — очень хрупкое вещество, которое не поддается ковке, а измельчить его можно даже вручную.
Итак, типичные неметаллы и металлы обладают противоположными свойствами, но деление это достаточно условно, поскольку ряд веществ сочетает в себе и те и другие признаки.