Наиболее часто металлы имеют кристаллические решетки следующих типов: Кубическая объемно-центрированная или сокращенно ОЦК (свинец, вольфрам) 9 атомов; Кубическая гранецентрированная (ГЦК) (серебро, золото) 14 атомов; гексагональная плотно-упакованная (ГПУ) (магний, цинк). Решетки ГЦК и ГПУ более компактны, чем ОЦК.
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ
). Такой тип структуры называется
металлической связью
.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
Металлы имеют относительно сложные типы кубических решеток – объемно центрированная (ОЦК) и гранецентрированная (ГЦК) кубические решетки.
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 1.2,б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с
параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с
/
а
всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения:
Только сон приблежает студента к концу лекции. А чужой храп его отдаляет.
8588 – | 7405 – или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock! и обновите страницу (F5)
очень нужно
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. В каждую эпоху предпочтение отдавалось разным видам этих удивительных веществ. Так, IV-III тысячелетия до нашей эры считаются веком хальколита, или медным. Позже его сменяет бронзовый, а затем в силу вступает тот, что и по сей день является актуальным – железный.
Сегодня вообще сложно представить, что когда-то можно было обходиться без металлических изделий, ведь практически все, начиная от предметов быта, медицинских инструментов и заканчивая тяжелой и легкой техникой, состоит из этого материала или включает в свой состав отдельные части из него. Почему же металлы сумели завоевать такую популярность? В чем проявляются особенности и как это заложено в их строении, попробуем разобраться далее.
Общее понятие о металлах
«Химия. 9 класс» – это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Читать также: Каким током заряжать пальчиковые аккумуляторы
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.
Железо, свойства атома, химические и физические свойства.
Fe 26 Железо
55,845(2) 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Железо — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Расположен в 8-й группе (по старой классификации — побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Атом и молекула железа. Формула железа. Строение атома железа
Изотопы и модификации железа
Свойства железа (таблица): температура, плотность, давление и пр.
Физические свойства железа
Химические свойства железа. Взаимодействие железа. Химические реакции с железом
Получение железа
Применение железа
Таблица химических элементов Д.И. Менделеева
Свойства металлов
К специфическим свойствам рассматриваемых веществ относят следующие.
- Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
- Ковкость и пластичность – способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
- Электропроводность и теплопроводность – одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.
Кристаллизация сплавов
Переход металла из жидкого состояния в твёрдое с образованием кристаллической структуры называется первичной кристаллизацией.
Образования новых кристаллов в твёрдом кристаллическом веществе называется вторичной кристаллизацией (перекристаллизацией).
Процесс кристаллизации состоит из двух одновременных процессов:
- зарождение кристаллов;
- линейный рост кристаллов;
Кристаллы могут зарождаться самопроизвольно (самопроизвольная кристаллизация) или зарождаться и расти на имеющихся готовых центрах кристаллизации (не самопроизвольная кристаллизация) (рис 33).
Рис 34 Рост зародышевых центров и рост кристаллов
Самопроизвольная кристаллизация (рис.35) обусловлена стремлением вещества иметь более устойчивое состояние, характеризуемое уменьшением термодинамического потенциала G, характеристика свободной энергии системы. Второй закон термодинамики – любая система всегда стремится занять то состояние, чтобы она обладала min свободной энергией. Температура, при которой термодинамические потенциалы вещества, как в твёрдом, так и в жидком состояниях равны, называется равновесной температурой (термодинамической температурой) ТG.
Рис.35 Самопроизвольная кристаллизация
Термодинамический потенциал определяется:
G = Е – ТS + РV (по Гельмгольцу)
где G – термодинамический потенциал, свободная энергия системы,
Е – внутренняя энергия системы,
Т – термодинамическая температура
S – энтропия (функция состояния: порядка и беспорядка, связанное с поступательным и колебательным движением),
РV – работа внешних сил (давление на объём)
G = Н – ТS (по Гиббсу)
где Н – энтальпия (Е + РV) сумма работ внутренних и внешних сил.
Разница между равновесной (ТG.) и реальной (Тр) температурой кристаллизации называется степенью переохлаждения (Δ Т).
Образованию зародышей способствуют флуктуации энергии, т.е. отклонение энергии группировок атомов в отдельных зонах жидкого металла от некоторого среднего значения.
Появление зародышей изменяет термодинамический потенциал (свободную энергию) всей системы. С одной стороны, при переходе жидкости в кристаллическое состояние термодинамический потенциал G уменьшается, с другой стороны, он увеличивается (+) вследствие появления поверхности раздела между жидкостью и кристаллическим зародышем.
На рис.36 показано, как изменяется свободная энергия системы при кристаллизации.
Кинетика кристаллизации. Скорость образования зародышей, образующихся в единицу времени в единице объёма (1мм-3с-1); скорость роста – увеличением линейных размеров, растущих кристалла в единицу времени (мм/с). Оба процесса связаны с перемещением атомов и зависят от температуры (степени переохлаждения Δ Т).
Не самопроизвольная кристаллизация (гетерогенная)
В реальных условиях процессы кристаллизации и характер образующих структур в значительной мере зависят от имеющихся готовых центров кристаллизации. Такими центрами являются:
- тугоплавкие частицы неметаллических включений;
- оксиды;
- интерметаллические соединения, образуемых примесей.
Измельчение структуры способствует улучшению механических свойств металла.
Рис.36 Изменение свободной энергии при кристаллизации
На практике для измельчения структуры металла и сплавов широко применяют технологическую операцию, называемую модифицированием. Она состоит во введении в жидкий сплав перед заливкой специальных добавок модификаторов (бор в сталь, натрий в алюминий и его сплавы). Подстуживание металла перед заливкой до температур, незначительно превышающих температуру плавления металла, способствует уменьшению размера зерна.
Формирование кристаллов
Форма и размер зёрен, образующихся при кристаллизации, зависят:
- скорости и направления отвода тепла:
- температуры жидкого металла;
- содержание примесей.
Структура слитка зависит от многих факторов: (рис.37)
- количество и свойства примесей в чистом металле;
- количества легирующих элементов в сплаве;
- температуры разливки сплава;
- скорость охлаждения при кристаллизации и т.д.
Рис.37 Схема строения металлического слитка, полученного при разных температурах
Типичная структура слитка сплавов состоит из трёх зон: (рис.38)
- мелкие равноосные кристаллы на поверхности слитка, из-за большой степени переохлаждения;
- столбчатые кристаллы, наиболее благоприятно ориентированные по отношению к теплоотводу, расположенные нормально к стенкам формы;
- равноосные кристаллы больших размеров в середине слитка, где наблюдается наименьшая степень переохлаждения и не ощущается направленного отвода тепла.
Структура, состоящая из одних столбчатых кристаллов, называется транскристаллитной. Встречается у слитков очень чистых металлов.
Химическая неоднородность по отдельным зонам слитка называется зональной ликвацией. Она отрицательно влияет на механические свойства сплава. В реальных сплавах кроме зональной встречаются и другие виды ликвации.
Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки. Химия, физика и металловедение – это науки, которые занимаются изучением особенностей строения таких структур.
Сама элементарная ячейка – это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
Читать также: Как выжигать на дереве током
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность – в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
- Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
- Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
- Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Типы кристаллических решеток
Четырнадцать вариантов строения решетки принято объединять в три основных типа. Они следующие:
- Объемно-центрированная кубическая.
- Гексагональная плотноупакованная.
- Гранецентрированная кубическая.
Кристаллическое строение металлов было изучено только благодаря электронной микроскопии, когда стало возможным получать большие увеличения изображений. А классификацию типов решеток впервые привел французский ученый Браве, по фамилии которого их иногда называют.
Объемно-центрированная решетка
Строение кристаллической решетки металлов данного типа представляет собой следующую структуру. Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название «объемно-центрированная».
Это один из вариантов наиболее простого строения элементарной ячейки, а значит, и всей решетки в целом. Такой тип имеют следующие металлы:
- молибден;
- ванадий;
- хром;
- марганец;
- альфа-железо;
- бетта-железо и другие.
Основные свойства таких представителей – высокая степень ковкости и пластичности, твердость и прочность.
Гранецентрированная решетка
Кристаллическое строение металлов, имеющих гранецентрированную кубическую решетку, представляет собой следующую структуру. Это куб, который включает в свой состав четырнадцать атомов. Восемь из них формируют узлы решетки, а еще шесть расположены по одному на каждой грани.
Подобную структуру имеют:
Основные отличительные свойства – блеск разного цвета, легкость, прочность, ковкость, повышенная устойчивость к коррозии.
ПРИМЕНЕНИЕ
Железо — один из самых используемых металлов, на него приходится до 95% мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму. Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Значение знаний о кристаллическом строении металлов
Из вышеизложенного материала очевидно, что знания о тонкой структуре и строении позволяют спрогнозировать свойства материала и повлиять на них. И это позволяет делать наука химия. 9 класс общеобразовательной школы делает в процессе обучения упор на то, чтобы сформировать у учащихся четкое понятие о важном значении основополагающей логической цепочки: состав – строение – свойства – применение.
Читать также: Каким припоем паять микросхемы
Сведения о кристаллическом строении металлов очень четко иллюстрирует эту зависимость и позволяет учителю наглядно объяснить и показать детям, насколько важно знать тонкую структуру, чтобы правильно и грамотно использовать все свойства.
Содержание:
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90%. Содержание железа в земной коре составляет 5%, а в мантии около 12%.
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70% Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4% Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8%
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
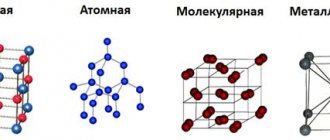
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
ПРОИСХОЖДЕНИЕ
Происхождение теллурическое (земное) железо редко встречается в базальтовых лавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.










![Турнирный мост Эглинтон[en] (завершено около в 1845 году), Норт-Эршир, Шотландия, построен из чугуна](https://santehekonomservis.ru/wp-content/uploads/turnirnyj-most-eglinton-en-zaversheno-okolo-v-1845-godu-nort2-330x140.jpg)