Металлы плавятся, как правило, при очень высокой температуре, которая может достигать более 3 тыс. градусов. Хотя некоторые из них можно расплавить в домашних условиях, например, свинец или олово. А вот ртуть плавят при температуре минус 39 градусов. В домашних условиях этого добиться не удастся. Температура плавления — это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
Железо и его свойства
Железо — это химический элемент, который в таблице Менделеева находится под номером 26. Это один из самых распространенных элементов во всей Солнечной системе. Согласно материалам исследований, в составе ядра Земли находится примерно 79−85% этого вещества. В земной коре его тоже присутствует большое количество, но оно уступает алюминию.
В чистом виде металл имеет белый цвет с чуть серебристым оттенком. Он пластичен, но имеющиеся в нем примеси могут определять его физические свойства. Реагирует на магнит.
Железо присутствует в воде. В речных водах его концентрация равна примерно 2 мг/л металла. В морской воде его содержание может быть ниже в сто или даже тысячу раз.
Оксид железа — это основная форма, добыча которой осуществляется и которая находится в природе. Оксидное железо может располагаться в самой верхней части земной коры и быть составляющей осадочных образований.
Элемент, находящийся на двадцать шестом месте в таблице Менделеева, может иметь несколько степеней окисления. Именно они определяют его геохимическую особенность нахождения в определенной среде. В ядре Земли металл присутствует в нейтральной форме.
Плавление металла это физическое или химическое
Плавление графита и металла это физические или химические явления?Почему?
Ответы и объяснения 1
Физические явления, потому что плавиться под огнём и происходит диформация.Это физические явления.
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат – это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Добыча полезных ископаемых
Руд, в которых присутствует железо, существует несколько. Однако, в качестве сырья для производства железа в промышленности используют в основном следующие:
- магнезитовую руду;
- гетитовую руду;
- гематитовую руду.
А также часто встречаются такие разновидности руды:
- леллингит;
- сидерит;
- марказит;
- ильменит;
- ярозит.
Существует еще минерал под названием мелантерит. Его используют преимущественно в фармацевтической промышленности. Из себя он представляет зелёного цвета хрупкие кристаллы, в которых присутствует стеклянный блеск. Из него производят лекарственные препараты, в составе которых имеется ферум.
Основным месторождением этого металла является Южная Америка, а именно Бразилия.
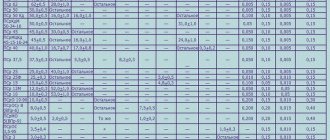
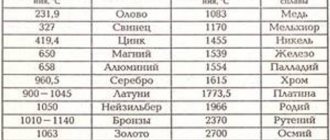
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Читать также: Как сделать винтовой домкрат своими руками
Таблица температур плавления металлов и сплавов
| Название | T пл, °C |
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 1100−1500 |
| Чугун | 1110−1400 |
| Железо | 1539 |
| Ртуть | -38,9 |
| Мельхиор | 1170 |
| Цирконий | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| Германий | 938,2 |
| Жесть | 1300−1500 |
| Бронза | 930−1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| Молибден | 2890 |
| Свинец | 327,4 |
| Бериллий | 1287 |
| Победит | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| карбид титана | 3150 |
| карбид циркония | 3530 |
| Галлий | 29,76 |
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Плавление железа и необходимая температура
Точкой плавления металла называют такую минимальную температуру, при которой он переходит из твердого состояния в жидкое. При этом в объеме он практически остается неизменным.
Металл могут производить из руды различными способами, но самый основной из них — это доменный. Помимо доменного, используют еще выплавку железа при помощи обжига измельченной руды с примесью глины. Из полученной смеси формируют окатыши, которые обрабатываются в печи с последующим восстановлением водородом. Далее плавление железа осуществляется в электрической печи.
Температура плавления железа весьма высока. Для технически чистого элемента она составляет +1539 °C. В этом веществе присутствует примесь — Сера, которую можно извлечь лишь в жидком виде. Без примесей чистый материал получают при электролизе солей металла.
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне:
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.
- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на:
- Легкоплавкие, до 600 °C. К ним относятся олово, цинк, свинец и другие.
- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.
- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.
Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Классификация металлов по температуре плавления
Разные металлы могут переходить в жидкое состояние при разной температуре. Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
- Легкоплавкие — те элементы, которые могут становиться жидкими уже при температуре ниже 600 градусов. К ним относят цинк, олово, свинец и пр. Их можно расплавить даже в домашних условиях — просто нужно разогреть при помощи плиты или паяльника. Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах.
- Среднеплавкие — элементы, которые начинают расплавляться при температуре от шестисот до тысячи шестисот градусов. Эти элементы используют по большей части для строительных элементов и металлоконструкций, то есть при создании арматур, плит и строительных блоков. В эту группу входят: железо, медь, алюминий. Температура плавления алюминия сравнительно низка и составляет 660 градусов. А вот железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов. Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
- Тугоплавкие — это такие материалы, которые расплавляются и становятся жидкими при температуре выше 1600 градусов. В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Единственный элемент, который при обычных условиях находится в жидком состоянии — это ртуть. Температура его плавления составляет минус 39 градусов и его пары являются ядовитыми, поэтому его используют только в лабораториях и закрытых ёмкостях.
Читайте также
Строение древесины
Строение древесины Сделав только поперечный срез, можно четко рассмотреть строение древесины. Каждый брусок необтесанного дерева имеет кору – это кожа дерева, которая не используется в работе, ее обязательно снимают. Под корой располагается зона роста дерева, которая
Строение древесины
Строение древесины Сделав только поперечный срез, можно четко рассмотреть строение древесины. Каждый брусок необтесанного дерева имеет кору – это кожа дерева, которая не используется в работе, ее обязательно снимают. Под корой располагается зона роста дерева, которая
ЛЕКЦИЯ № 1. Строение древесины
ЛЕКЦИЯ № 1. Строение древесины 1. Виды древесных пород и части дерева Растущие деревья имеют следующие составные части: корни, ствол, ветви, листья. Корневая система деревьев выполняет функции поставщика влаги и питательных веществ из почвы по стволу и ветвям к листьям.
Макроскопическое строение древесины
2. Макроскопическое строение древесины При поперечном разрезе ствола дерева можно установить главные макроскопические признаки: заболонь, ядро, годичные слои, сердцевинные лучи, сосуды, смоляные ходы и сердцевинные повторения.У молодых деревьев всех пород древесина
Строение металлов
1. Строение металлов Металлы и их сплавы – основной материал в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот. Для того чтобы
Свойства расплавов стекол
Свойства расплавов стекол К свойствам расплавов стекломассы относятся вязкость, связанная с ней скорость твердения, поверхностное натяжение и кристаллизация, а также теплоемкость, теплопроводность, электрическая проводимость. Значение этих свойств при производстве
§ 3.3 Строение атомов и периодический закон Менделеева
§ 3.3 Строение атомов и периодический закон Менделеева Свойства простых тел, а также формы и свойства соединений элементов, находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую функцию) от их атомных весов. Д.И. Менделеев Считается,
§ 3.6 Строение ядер
§ 3.6 Строение ядер Чем больше в ядре должно поместиться нуклонов, тем больше должна быть площадь поверхности ядра, где происходят присоединения то протонов, то нейтронов… Этим особенностям лучше всего отвечает форма ядра в виде двух пирамид Хеопса, соединённых
§ 4.14 Строение вещества и химическая связь
§ 4.14 Строение вещества и химическая связь Что, наконец, представляется нам затверделым и плотным, То состоять из начал крючковатых должно несомненно, Сцепленных между собой наподобие веток сплетённых. В этом разряде вещей, занимая в нём первое место, Будут алмазы
Глава 32 Строение Пространства – Времени
Глава 32 Строение Пространства – Времени «Действие есть кривизна Мира» Павел Дмитриевич Успенский, 1911 год Мы уже предполагали аналогии квантового строения микромира и макромира, при определенных условиях. Далее, будет показаны законы резонансного строения нашего
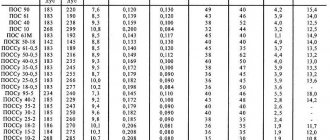
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
| Металл | Сопротивление, МПа |
| Медь | 200−250 |
| Серебро | 150 |
| Олово | 27 |
| Золото | 120 |
| Свинец | 18 |
| Цинк | 120−140 |
| Магний | 120−200 |
| Железо | 200−300 |
| Алюминий | 120 |
| Титан | 580 |
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Металлы плавятся, как правило, при очень высокой температуре, которая может достигать более 3 тыс. градусов. Хотя некоторые из них можно расплавить в домашних условиях, например, свинец или олово. А вот ртуть плавят при температуре минус 39 градусов. В домашних условиях этого добиться не удастся. Температура плавления — это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
Читать также: Импульсный блок питания 12 вольт своими руками
Особенности плавки цветных металлов и сплавов
Взаимодействие металлургических расплавов с газами и материалами футеровки плавильных печей
В большинстве случаев плавку цветных металлов ведут на воздухе. Металлические расплавы взаимодействуют с атмосферой и огнеупорными материалами, они по ходу плавки могут загрязняться различного рода примесями.
Газовой средой, с которой при плавке и разливке соприкасается металлический расплав, является не только обыкновенный воздух, но и продукты сгорания органического топлива, различные специально используемые газы (аргон, азот, гелий), т.е. в газовой среде над расплавом могут содержаться кислород, азот, пары воды, оксиды углерода (СО и СО2), сернистый газ SO2, метан СН4.
Взаимодействие металлического расплава с газовой средой может быть трех типов:
-первый тип — расплав не вступает во взаимодействие с газами и не растворяет в себе газ (полная инертность); так ведут себя все жидкие металлы в атмосфере инертных газов (аргон, гелий и др.). Практически полная инертность наблюдается между многими элементами и азотом (медь — азот, цинк — азот и др.), а также водородом (олово — водород, свинец — водород) и кислородом (золото -кислород);
-второй тип — образуется устойчивое соединение металл — газ; это происходит между кислородом и жидким алюминием, магнием, цинком, оловом. Расплав загрязняется частицами этих соединений;
-третий тип — в расплаве образуются растворы газа; подобный тип взаимодействия наблюдается во многих системах металл — водород (М§, Al, Cu, Ni, Fe), металл — кислород (Cu, Ni, Fe).
Взаимодействие основных цветных металлов с газами представлено табл. 1.
Таблица 1
Образование растворов газов и газообразующих элементов в жидких металлах
Газ или газообразующий элемент Металл
| Mg | Al | Ag | Cu | Mn | Ni | Fe | Ti | Cr | |
| Водород | + | + | + | + | + | + | + | + | + |
| Кислород | — | — | + | + | + | + | + | + | + |
| Азот | — | — | — | — | + | + | + | + | + |
| Углерод | — | — | — | — | + | + | + | + | + |
| Сера | — | + | + | + | + | + | + | + | + |
| Примечание: Знак (-) указывает на отсутствие растворимости газов; знак (+) указывает на практически значимую растворимость | |||||||||
Водород обычно составляет основную долю газов, обнаруживаемых в растворенном состоянии в металлах. Главный источник водорода — вода, которая реагирует с расплавом по реакции Ме + Н2О — МеО + 2[Н]Ме, т.е. металл восстанавливает водород, который в атомарном состоянии легко растворяется в расплаве (табл.1). Вода содержится в шихте, футеровке, шлаках.
Кислород активно взаимодействует с большинством металлов, образуя оксиды и растворы кислорода. Если кислород находится в растворенном виде, то необходимо раскисление, т.е. перевод кислорода в нерастворимую форму. Нерастворимые оксиды удаляются из расплава отстаиванием, фильтрованием и пр.
Легкоплавкие металлы, включая Mg и Al, не растворяют кислород (табл.1), их взаимодействие выражается только в образовании на поверхности расплавов пленки нерастворимых оксидов. Сплавы на основе легкоплавких металлов при любых легирующих элементах ведут себя с кислородом подобно чистым металлам.
Особенность поведения растворов кислорода в жидких металлах при плавке на воздухе состоит в том, что при охлаждении и кристаллизации расплава этот газ никогда не выделяется в свободном виде, а переходит либо целиком в твердый раствор (система Ti-O), либо в твердые соединения — оксиды (системы Cu-O, Fe-O).
Азот в легкоплавких металлах не растворяется (табл.1). Более тугоплавкие металлы, начиная с марганца, растворяют азот, причем в Mn, Niи Feпри понижении температуры, особенно при кристаллизации, растворимость азота в металлах снижается, и это может вызвать появление газовой пористости азотного происхождения. В расплавах Ti, Vи Cr, насыщенных азотом, наоборот, при снижении температуры азот полностью переходит в твердый раствор (Ti-N) или образует нитриды (Cr-Ni).
Азот, оставшийся в твердом металле, является причиной резкого снижения пластичности металла, особенно если образует хрупкие нитридные фазы.
Пары воды взаимодействуют почти со всеми металлами при тех температурах, когда они находятся в жидком состоянии. Легкоплавкие металлы не растворяют в себе ни кислород, ни водород. Следовательно, в жидком состоянии эти металлы будут окисляться парами воды и покрываться пленкой нерастворимых оксидов. Жидкий Mg и Al будут растворять выделяющийся водород. Поэтому плавка этих металлов в атмосфере, содержащей вредные пары, будет вызывать не только загрязнение расплава неметаллическими включениями оксидного характера, но и насыщать его водородом. Все остальные металлы (табл.7) способны растворять и кислород и водород. Поэтому при плавке в атмосфере, содержащей водяные пары, они будут загрязняться и водородом и кислородом.
Оксид углерода СО с легкоплавкими металлами (до алюминия) взаимодействует по реакции Ме + СО = МеО + С. Более активные металлы из данной группы (Mg, Al) будут окисляться в атмосфере СО при обычных температурах плавления. Поэтому атмосфера этого газа для данного металла является окислительной, вызывающей загрязнение расплава неметаллическими включениями.
Жидкие медь и серебро способны растворять кислород, но в контакте с СО расплавы устойчивы. Это объясняется тем, что реакция между металлом и СО практически не идет. Оксид углерода является надежной защитной средой при плавке этих металлов.
Все остальные жидкие металлы, указанные в табл. 1, растворяют и кислород и углерод. Поэтому они насыщаются при плавке растворенными углеродом и кислородом, и при кристаллизации в металле возникает пористость, образованная ионооксидом углерода.
Диоксид углерода (СО2) практически не взаимодействует с жидким металлом, обладающим малым сродством к кислороду (Bi,
Pb, Аg, Сu
). Поэтому плавку этих элементов можно производить в среде СО2. Для всех остальных металлов чистый СО2 является окислительным газом.
Сернистый газ (SO)2cметаллами, которые не растворяют кислород, но растворяют серу (Sn, Рв, Al), взаимодействуют по реакции
2Ме + SO2 ↔ 2MeO+ [S]
Следовательно, расплавы этих металлов будут загрязняться включениями оксидов и растворенной серой. Для металлов, способных растворять кислород и серу (Ag, Cu, Mn, Ni, Fe), реакция с SO2 может быть записана в следующем образом:
Ме + SO2 ↔ Me+ [S] + 2[O]
При понижении температуры у всех металлов равновесие сдвигается вправо, в сторону разложения SO2. Исключение составляют медь и серебро, у которых снижение температуры смещает равновесие влево, в сторону образования SO2.
Метан (СН4) может присутствовать в атмосфере газовых печей, работающих на мазуте и природном газе. Метан при температуре выше 1000оС диссоциирует на элементы, что может вызвать насыщение расплава водородом и углеродом одновременно.
Жидкие металлы, находясь в плавильных печах и тиглях, соприкасаются с материалами, используемыми для футеровки ванн плавильных печей и разливочных ковшей, а также для изготовления плавильных тиглей. Эти материалы можно разделить на оксидные, оксидно-графитовые, чисто графитные, карборундовые, металлические.
Наиболее опасным является взаимодействие металлического расплава с оксидом футеровки по реакции Ме + RO↔ Me+ [R]. При таком взаимодействии не только разрушается футеровка, но и происходит загрязнение расплава восстановленным элементом Rи оксидами Ме или растворенным кислородом.
Оксидно-графитовые материалы, представляющие собой смесь шамота с 30 — 40% графита, имеют огнеупорность 1300 — 1400 оС и используются для плавки металлов, не взаимодействующих с С и SiO2. Шамотно-графитовые тигли используют для плавки алюминия, меди и их сплавов, а также сплавов на основе золота и серебра.
Графит на воздухе очень быстро сгорает, начиная с 600 — 700оС, хотя сам по себе способен работать до 2500оС. Графитовые огнеупоры пригодны для плавки легкоплавких металлов. Наиболее часто графит применяют для плавки меди и ее сплавов, однако, начиная с 600оС, необходима защита от их окисления.
Карборундовые материалы (~ 80% SiC, остальное — тугоплавкие оксиды) очень огнеупорны (~ 2000оС) и химически стойки. Карборундовая футеровка применяется для плавки алюминиевых и медных сплавов, которые практически не реагируют с SiC.
Металлические материалы используются для изготовления плавильных емкостей, предназначенных для выплавки сравнительно легкоплавких материалов. Этими материалами в основном являются чугун и сталь. Основной вид взаимодействия расплавов с подобными материалами — простое растворение железа, причем загрязнение железом некоторых металлов может быть достаточно велико, например: при 700 оС в алюминии может раствориться 2,5% Fe. Чтобы предотвратить насыщение расплавов железом, внутреннюю поверхность тиглей окрашивают специальным составом.
Таким образом, получаемые при плавке расплавы могут содержать различные примеси, которые вносятся исходными материалами (шихтой), появляются в ходе плавки в результате взаимодействия с атмосферой и огнеупорными материалами.
Примеси в металлических расплавах могут присутствовать в растворенном виде и в виде нерастворимых взвешенных частиц. К растворимым примесям относятся:
-металлы (Рb, Sn, Alв сплавах на основе железа, никеля и меди; Feв сплавах на основе алюминия и магния);
-неметаллы (S, P, Si, Cи др.);
-газы (Н, O, N).
К нерастворимым примесям относятся:
-неметаллические включения (оксиды, нитриды и др.);
-включения металлической природы (интерметаллиды).
Защита расплавов от взаимодействия с атмосферой
Если при взаимодействии с воздухом на поверхности расплава образуются нерастворимые соединения и возникающая пленка этих соединений замедляет дальнейшее взаимодействие, то в этом случае плавку ведут при прямом контакте с атмосферой (например, плавление большинства алюминиевых сплавов). Если же образующаяся пленка непрочна и неспособна защитить расплав от дальнейшего взаимодействия, то принимают специальные меры, используя флюсы, шлаки или защитные атмосферы.
Защитные флюсы и шлаки — это сложные сплавы солей и оксидов, загружаемых на поверхность расплава. Флюсы вводят для образования жидких шлаков, очищающих металл от нежелательных примесей. В зависимости от назначения флюсы подразделяют на покровные (защитные), рафинирующие и универсальные. Флюсы и шлаки должны быть более легкоплавкими, чем защищаемый металлический расплав, менее плотными, чем жидкий металл и быть непроницаемыми для газов воздуха. Например, защитный шлак для плавки медных сплавов состоит из 73% SiО2 и 27% NaOи плавится при 795оС (водный раствор этого соединения называют жидким стеклом). Недостаток — испарение.
В тех случаях, когда невозможно или нежелательно использовать шлак или флюс, например при приготовлении сложных сплавов с химически активными добавками, а также из-за опасности разъедания футеровки и загрязнения расплава используют защитные атмосферы, например аргон, или применяют плавку в вакууме (это наиболее надежный способ получения чистых металлов). Но, несмотря на защиту, металлические расплавы все же загрязняются различными примесями металлов и неметаллов, растворимыми и нерастворимыми в расплаве.
Рафинирование (очистка) расплавов
Растворимые примеси удаляют химическими способами, нерастворимые (неметаллические включения) примеси — механическими способами.
Рафинирование расплавов от растворенных примесей проводят во время приготовления сплава путем окисления, хлорирования, обработки флюсами или вакуумной дистилляцией.
Рафинирование окислением применяют в тех случаях, когда сплав способен растворять кислород. Этим методом можно очистить расплав от примесей, имеющих большее сродство к кислороду, чем основной компонент рафинируемого сплава.
Окислительное рафинирование проводят продувкой воздухом или введением в расплав окислителей. При контакте расплава с кислородом прежде всего происходит окисление основного металла, и расплав насыщается кислородом. После этого растворенные примеси, соединяясь с кислородом, образуют нерастворимые оксиды, которые переходят в шлак.
Хлорирование — это продувка расплавов газообразным хлором. Применяется для удаления примесей, обладающих большим сродством к хлору, чем основной металл и главные легирующие компоненты сплавов (например, удаление примесей Naи Mgиз алюминиевых сплавов).
Рафинирование флюсованием применяют для удаления примесей, которые образуют летучие или легко шлакующиеся соединения с флюсом, не растворяющиеся в основном металле (например, очистка алюминиевых сплавов от магния криолитом).
Рафинирование вакуумной дистилляцией применяют для удаления примесей, имеющих большее давление пара, чем основной металл (например, удаление цинка из алюминия).
Нерастворимые примеси могут иметь самые разнообразные размеры — от долей микрометра до миллиметров. В основном это оксидные соединения, хотя могут быть нитриды, карбиды, карбонитриды. Их называют неметаллическими включениями. Они резко снижают пластичность металлов, особенно при ударных нагрузках и низких температурах, а также существенно понижают коррозионную стойкость сплавов.
Источниками этих включений являются частицы футеровки, шлака, флюса, шихты, продукты физико-химических процессов, протекающих в расплаве.
Неметаллические включения можно удалить отстаиванием, продувкой газами, вакуумированием, обработкой флюсами и шлаками, фильтрованием.
Отстаивание, как правило, процесс длительный. Крупные частицы (более 100 мкм) отделяются за несколько минут, средние (10 — 100 мкм) — за десятки минут, а мелкие (менее 5 мкм) практически невозможно отделить отстаиванием. Этот прием неспособен дать глубокую очистку, но из-за своей доступности применяется часто.
Сущность рафинирования путем продувки газами или обработкой летучими веществами заключается в том, что газовые пузыри, проходя через расплав, захватывают встречающиеся на своем пути инородные включения и выносят их на поверхность расплава. Продувка газами позволяет удалить как крупные, так и мелкие (до 1 мкм) частицы. Для продувки обычно применяют аргон или азот. Иногда к аргону добавляют хлор (например, при продувке алюминиевых сплавов). Хлор разрушает оксидную пленку на внутренней поверхности газового пузырька, в результате чего улучшается прилипание пузырьков к частицам. Вместо газов для рафинирования алюминиевых сплавов используются также летучие твердые соединения — хлориды алюминия и марганца, хлористый цинк, гексахлорэтан и др. При обработке расплавов хлоритсый алюминий AlCl3, хлористый аммоний NH4Clвозгоняются, так как имеют низкую температуру возгонки: первый 180оС, второй 338оС. Хлориды марганца и цинка вступают во взаимодействие с расплавом:
3MnCl2 + 2Al— 2 AlCl3 + 3Mn, 3ZnCl2 + 2Al— 2AlCl3 + 3Zn.
Практически происходит продувка парами хлоридов алюминия.
При вакуумном рафинировании используется флотирующее действие пузырьков газа, выделяющихся из раствора. Остаточное давление при вакуумировании составляет 500 — 1000 Па.
Рафинирование обработкой флюсами основано на переходе частиц нерастворенных примесей в шлак или флюса в результате растворения или смачивания. Флюсы содержат повышенное количество фтористых солей и оксида натрия в виде Na2CO3. При этом способе необходимо активное перемешивание расплава с флюсом или шлаком. После рафинирования проводят отстаивание для всплытия капель шлака или флюса.
Наиболее эффективным способом удаления из расплава частиц нерастворимых примесей является фильтрование.
Рафинирование расплавов от растворенных газов (дегазация) — это удаление из расплавов водорода, азота, оксида углерода. Удаление растворенного кислорода осуществляется раскислением. Дегазацию осуществляют вымораживанием, продувкой газами, вакуумированием, обработкой флюсами, различными физическими воздействиями на металл.
Дегазация вымораживанием основана на уменьшении растворимости газов с понижением температуры. В печи расплав медленно охлаждают (вплоть до частичной кристаллизации), при этом растворенные газы выделяются в атмосферу через открытую поверхность расплава. После этого металл снова нагревают с максимальной скоростью. Этот способ весьма длительный, но достаточно эффективный.
Дегазация расплавов продувкой нерастворимыми газами основана на том, что в пузырьке такого газа парциальное давление растворенного в расплаве газа равно нулю и растворенный газ переходит из расплава в пузырек. В этом случае необходима большая поверхность пузырьков, т.е. желателен наименьший их размер (не более 0,1 — 0,5 мм).
Для продувки используют аргон (все сплавы), азот (медные и алюминиевые сплавы), азот с хлором (алюминиевые сплавы). Иногда используют летучие соединения — хлористый марганец (для медных и алюминиевых сплавов), хлористый цинк и гексахлорэтан (для алюминиевых сплавов).
Наиболее надежно позволяет дегазировать металлические расплавы вакуумирование. Понижение давления над расплавом приводит к выделению газов не только через поверхность расплава, но и во всем объеме в виде пузырьков. Центрами выделения растворенного газа являются мельчайшие пары и трещины на поверхности частиц примесей, всегда присутствующих в расплавах. Поэтому вместе с газовыми пузырьками на поверхность расплава всплывают и частицы примесей.
При обработке расплавов шлаками и флюсами также происходит дегазация. Однако механизм такого воздействия до конца не изучен.
Установлено, что некоторые физические воздействия на расплав (например, ультразвуковые колебания или обработка постоянным током) приводит к дегазации. Точная природа этих процессов пока не выяснена.
Раскисление металлических расплавов
Раскисление (удаление растворенного кислорода) производят лишь при плавке тех металлов и сплавов, которые способны, находясь в жидком состоянии растворять кислород. Из цветных металлов обязательному раскислению подвергают никель и сплавы никеля с медью, железом, хромом, марганцем при обычной плавке на воздухе. Чистую медь и сплавы меди с серебром и никелем также необходимо раскислять. Сплавы меди с такими активными по отношению к кислороду металлами, как Zn, Al, Cr, Zr, почти не способны растворять кислород и для них раскисление не имеет смысла.
Сплавы на основе алюминия, магния, цинка, олова, свинца никогда не раскисляют. Кислород присутствует в расплавах этих металлов и их сплавов в связанном состоянии в виде нерастворимых неметаллических включений.
Модифицирование
Модифицирование — это изменение структуры твердого металла за счет введения специальных добавок или в результате определенных условий плавки и обработки расплава. При модифицировании, как правило, происходит измельчение структуры. Это приводит к улучшению технологической пластичности и повышению механических свойств.
Модифицировать можно путем перегрева расплава и быстрого его охлаждения. Такое модифицирование весьма эффективно для многих алюминиевых и медных сплавов. Наложение на кристаллизующийся расплав механических или ультразвуковых колебаний также приводит к измельчению структуры. Разработана так называемая суспензионная заливка — это вид модифицирования путем растворения в струе расплава твердого сплава того же состава.
Наиболее распространенный способ модифицирования — это введение добавок — модификаторов. Эти добавки или являются дополнительными центрами кристаллизации (например, AlP, Al3Ti, AsSc и др.), или затрудняют рост кристаллов (например, Na в алюминиевых сплавах).
Модифицирование с помощью добавок выполняют в конце плавки, так как модифицирующее действие добавок ограничено во времени. Количество добавок не превышает 0,1% от массы расплава.
Источник: Л.П. Кочеткова «Металлургические процессы в машиностроительном производстве» Киров 2004