Содержание
Одно и то же вещество может находиться в трех разных агрегатных состояниях в зависимости от условий. Например, лед, вода и водяной пар (рисунок 1).
Рисунок 1. Агрегатные состояния одного вещества на примере льда, воды и пара
Соответственно, это одно вещество в твердом, жидком и газообразном состоянии. Эти состояния отличаются друг от друга расположением, характером движения и взаимодействия молекул. В жидких и твердых телах, в отличии от газов, молекулы не могут далеко удалиться друг от друга. Изначально они расположены близко друг к другу и их средняя кинетическая энергия недостаточна для того, чтобы совершить работу по преодолению сил молекулярного притяжения.
Тем не менее, на практике мы часто наблюдаем, как тела переходят из твердого состояния в жидкое, и наоборот. Например, процесс таяния льда или его замерзания. В данном уроке мы более подробно рассмотрим эти процессы, узнаем при каких условиях они проходят.
Описание металла
Олово — металл редкий, в небольших количествах встречается в рудах и песках, особенно часто встречается слоях, поднимаемых со дна океана. По распространенности среди металлов в земной коре занимает 47-е место.
Для его получения используют руды, содержание данного металла в которых около 0,1%. Сначала руду обогащают (методом магнитной сепарации или гравитационной флотации). Таким образом, содержание олова повышается до 40–70%. Потом обжигают концентрат в кислороде для удаления примеси мышьяка и серы. Полученный, таким образом, материал восстанавливают в электропечах с помощью алюминия или угля. Выпускаются следующие виды данного материала: олово в чушке, в прутке, в проволоке. А также олово: пищевое и для лужения кузова.
Около 40% мирового производства олова идет на производство консервных банок. Остальное используют в металлургии, для получения разных сплавов. Самый известный сплав — это бронза, состоящая из олова и меди. И только 7% олова производимого в мире используется в виде химических соединений.
Плавление и температура плавления
- Если мы сообщим телу достаточную энергию, то возможно перевести его из твердого состояния в жидкое (расплавить лед) и из жидкого в газообразное (превратить воду в пар)
- Если же тело будет отдавать энергию, то оно может перейти из газообразного состояния в жидкое и из жидкого в твердое
Плавление — это переход вещества из твердого состояния в жидкое.
Чтобы началось плавление тела, его необходимо нагреть до определенной температуры.
Температура плавления вещества — это температура, при которой вещество плавится.
Разные вещества плавятся при разных температурах. Лед начнет плавится, если мы возьмем его в руку, а чтобы расплавить железо понадобится специальная печь. Кусок олова или свинца можно расплавить в стальной ложке.
В таблице 1 представлены температуры плавления различных веществ. Вы можете заметить, что их диапазон очень широк.
| Вещество | $t_{пл}, \degree C$ | Вещество | $t_{пл}, \degree C$ |
| Водород | -259 | Цинк | 420 |
| Кислород | -219 | Алюминий | 660 |
| Азот | -210 | Серебро | 962 |
| Спирт | -114 | Латунь | 1000 |
| Ртуть | -39 | Золото | 1064 |
| Лед | 0 | Медь | 1085 |
| Цезий | 29 | Чугун | 1200 |
| Калий | 63 | Сталь | 1500 |
| Натрий | 98 | Железо | 1539 |
| Олово | 232 | Платина | 1772 |
| Свинец | 327 | Осмий | 3045 |
| Янтарь | 360 | Вольфрам | 3387 |
Таблица 1. Температура плавления некоторых веществ (при нормальном атмосферном давлении)
ПЛАВЛЕ́НИЕ
ПЛАВЛЕ́НИЕ, переход вещества из твёрдого кристаллич. состояния в жидкое; фазовый переход 1-го рода, сопровождающийся скачкообразным изменением объёма и энтропии вещества. При постоянном давлении П. однокомпонентных веществ происходит при некоторой фиксированной темп-ре Тпл, называемой темп-рой плавления. Это свойство отличает кристаллич. вещества от аморфных, переход которых в жидкое состояние идёт постепенно в некотором интервале температур. В результате П. происходит позиционное разупорядочение системы: регулярное пространственное расположение атомов или молекул (дальний порядок) сменяется нерегулярным, причём ср. расстояния между частицами изменяются незначительно. В ряде молекулярных кристаллов выделяют также др. механизмы разупорядочения при П. (ориентационный, конфигурационный, колебательный). Энтропия вещества при П. возрастает, причём в зависимости от характера изменения структуры вещества те или иные механизмы разупорядочения вносят разл. вклад в её прирост. Напр., для полупроводников, переходящих при П. в металлич. состояние, существенный вклад в энтропию обусловлен увеличением концентрации электронов проводимости при П. Для разрыва связей между частицами при П. требуется энергия, величина которой зависит от конкретного вещества и называется теплотой плавления.
Темп-ры П. разных веществ лежат в широком интервале. Среди однокомпонентных веществ наиболее низкую темп-ру П. при атмосферном давлении имеет водород (Тпл=14 К); самым тугоплавким металлом является вольфрам (Тпл=3693 К), а наиболее тугоплавкими соединениями – карбиды, напр. ТаС (Тпл=4258 К) и HfC (Тпл=4163 К).
Рис. 1. Фазовая диаграмма однокомпонентного вещества; А – тройная точка; K – критическая точка.
На фазовой диаграмме однокомпонентного вещества (рис. 1) зависимость Тпл от давления (линия П.) описывается линией AB, соответствующей фазовому равновесию между кристаллом и жидкостью. Линия AD (продолжение линии П. в область отрицательных давлений) описывает метастабильное состояние равновесия кристалла с жидкостью, находящихся в растянутом состоянии. Ход линии П. определяется знаком изменения объёма. Для большинства веществ наблюдается увеличение объёма при П. и неограниченный рост Тпл при увеличении давления (нормальный ход линии П.). Это означает более высокую упорядоченность и плотность кристаллич. фазы по сравнению с расплавом. Вместе с тем известны вещества (напр., галлий, висмут, лёд), у которых при относительно низких давлениях наблюдается уменьшение объёма при П. и уменьшение Тпл с ростом давления (аномальный ход линии П.). При П. таких веществ происходит образование неупорядоченной структуры с более плотной упаковкой частиц. Однако с увеличением давления эти вещества испытывают полиморфный переход, после которого ход линии П. становится нормальным. На линиях П. некоторых веществ (напр., цезия, бария) наблюдается температурный максимум, за которым (при повышении давления) ход линии П. становится аномальным, причём в точке максимума кристалл и расплав имеют одинаковую плотность. При дальнейшем росте давления такие вещества испытывают полиморфный переход, после которого наклон кривых П. вновь становится положительным.
На линии П. (в отличие от линии равновесия жидкость–пар) отсутствуют особенности типа критической точки, что связано с различием симметрии кристалла и жидкости. Особый вид имеет фазовая диаграмма гелия: на ней отсутствует тройная точка равновесия кристалл– жидкость–пар. Гелий твёрдый может существовать только при повышенном давлении, которое при 0 К для 4He составляет ок. 2,5 МПа, для 3He – ок. 3,4 МПа.
При П. имеет место размерный эффект, который заметно проявляется в образцах субмикронного размера. В таких кристаллах большая доля атомов находится в поверхностном слое. Это приводит к тому, что переход от кристаллич. состояния к жидкому, связанный с понижением энергии термодинамич. системы, происходит при более низкой темп-ре, чем в массивных образцах. Напр., если для макроскопич. образца свинца Тпл=600 К, то для образцов размером 10, 5 и 3 нм Тпл составляет соответственно 580, 540 и 490 К.
Рис. 2. Фазовая диаграмма двухкомпонентной системы.
Для многокомпонентных систем Тпл зависит от их состава. Так, для двухкомпонентной системы с неограниченной растворимостью компонентов зависимость Тпл от концентрации x одного из них при постоянном давлении и одинаковой симметрии кристаллич. решёток имеет вид, изображённый на рис. 2. Концентрации компонентов в кристалле и расплаве, находящихся в равновесии, различны (хкр и хж на рис. 2 при темп-ре Т1). Линии S и L на диаграмме описывают соответственно зависимости темп-ры начала (кривая солидуса) и темп-ры окончания (кривая ликвидуса) П. от концентрации и ограничивают область, в которой сосуществуют кристаллы твёрдого раствора и расплав. Для случая ограниченной растворимости компонентов (с разл. симметрией кристаллич. решёток) фазовая диаграмма имеет более сложный вид.
П. играет важную роль в природе и жизнедеятельности человека (П. льда и снега, процессы в недрах Земли и космосе и др.). П. – составная часть мн. технологич. процессов (произ-во чистых металлов и сплавов, изделий из них).
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
| Металл | Сопротивление, МПа |
| Медь | 200−250 |
| Серебро | 150 |
| Олово | 27 |
| Золото | 120 |
| Свинец | 18 |
| Цинк | 120−140 |
| Магний | 120−200 |
| Железо | 200−300 |
| Алюминий | 120 |
| Титан | 580 |
Изготовление припоя
Для того чтобы повысить эксплуатационные характеристики припоя, в его состав добавляется небольшое количество сурьмы. Подобный вариант исполнения припоя применяется для пайки различных радиодеталей, особенно ответственных участков.
При выборе припоя следует уделить внимание и сплаву с серебром в составе. Его эксплуатационными качествами можно назвать:
- Существенно повышается срок эксплуатации. За счет серебра структура становится более устойчивой к процессу окисления.
- За счет повышения концентрация серебра появляется возможность использовать припой при изготовлении различных деталей промышленной техники. Однако серебро существенно повышает стоимость сплава, а также изготавливаемого изделия. Именно поэтому сплавы с высокой концентрацией серебра используют для изготовления важных деталей.
Проводится добавление в состав цинка, но подобные сплавы пользуются меньшей популярностью. Это связано с достаточно высокой химической активностью цинка. За счет взаимодействия с окружающей средой подобный сплав быстро разрушается. На основе цинкосодержащей смеси производятся припайные пасты, которые имеют относительно небольшой срок службы. Температура плавления в этом случае составляет 200 градусов Цельсия.
На протяжении многих лет используется и чистое олово в качестве полупроводникового припоя. Температура плавления этого элемента в чистом виде составляет 240 градусов Цельсия. Применяются они исключительно в промышленности, что связано с высокой стоимостью. В чистом виде из-за существенного повышения температуры структура олова перестраивается, на поверхности появляются черные пятна, которые указывают на существенное ухудшение основных качеств.
Понятие удельной теплоты кристаллизации
Под удельной теплотой кристаллизации (плавления) понимают количество энергии, высвобождаемой (потребляемой) 1 кг. вещества при переходе от жидкого состояния в твердое (и наоборот). Важно отметить, что в процессе кристаллизации (плавления) температура вещества не меняется и она уже доведена до величины, при которой возможен сам процесса.
Измеряется удельная теплота кристаллизации (плавления) в Дж/кг., обозначается буквой греческого алфавита λ. По определению:
где Q – это количество энергии, высвобождаемой (потребляемой) m килограммами вещества.
Типы сплавов металлов
Типы металлических сплавов различаются на основе температуры плавления, поэтому выделяют следующие варианты сплава:
- Легкоплавкий (олово, цинк, свинец, висмут) с температурой плавления не больше 600 °C.
- Среднеплавкий (алюминий, магний, никель, железо) с температурой 600 — 1 600 °C.
- Тугоплавкий (молибден, вольфрам, титан) с температурой более 1 600 °C.
Далее расскажем немного о разновидностях сталей, о сплаве вуда и припоях.
Особенности углеродистой стали
В данном материале содержится примесь углерода, примерно 2,13 %. При этом он лишен легирующих добавок, но есть примеси кремния, марганца и магния.
Особенности легированной стали
Помимо содержания углерода и железа в неё добавляют дополнительные элементы, улучшающие её свойства.
Особенности нержавейки
Нержавеющая сталь отлична от углеродистой из-за содержания элемента хрома в своем составе, благодаря свойствам которого она не подвержена окислению, а, следовательно, покрытию ржавчиной.
Особенности инструментальной стали
Также обладает углеродистым составом (0,8 – 0,9 %). Демонстрирует твердость, прочность, хорошо поддаются обработке. Используется в изготовлении инструментов, например, медицинских.
Сплав Вуда
Представляет собой материал, применяемый при паянии деталей для радиоприемников, а также в гальванической пластике, при работе в лабораторных условиях с ядохимикатами.
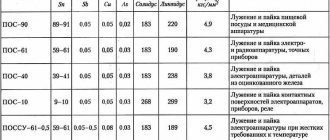
Сплавы для пайки
Другое их название – припои. Материалы для припоев бывают различными. Все зависит от того, что входит в состав материалов, которые необходимо соединить. К примеру, алюминий требует один сплав припоя, а вот медь уже совершенно другой.
Сплавы и некоторые особенности олова
Применение оловянных сплавов распространено в качестве антифрикционных материалов, то есть материалов, которые обладают низким коэффициентом трения, или способных снизить коэффициент трения других материалов. С помощью антифрикционных материалов можно значительно увеличить срок работы механизмов и машин, уменьшая потери трения.
Еще одна интересная особенность олова (так называемого белого) — это его свойство при снижении температуры до 13.2°С увеличивать объём на 25,6%. При этом образуется, так называемое, серое олово. При достижении температуры -33°С металл трескается и становится порошком. Если произойдет соприкосновение серого и белого металла, произойдет «заражение» белого. Совокупность таких явлений называют «оловянной чумой».
Различные сплавы на основе олова применяются в электротехнике при изготовлении электро-конденсаторов. В конденсаторах активно используют станиоль: практически чистый металл в виде тонких листов.