Трудно представить современное строительство, технику, машиностроение и другие важнейшие отрасли без применения главных металлических сплавов из стали и чугуна. Их производство превышает все остальные в десятки раз.
Если рассмотреть сталь и чугун с точки зрения такой науки, как металловедение, то центральной фигурой предстает диаграмма состояния сплавов железо-углерод, которая позволяет получить подробные представления о составе и структурных превращениях в этих материалах. А также познакомиться с их фазовым составом.
История открытия
Впервые на то, что в сплавах (сталях и чугунах) есть определенные (особые) точки, указал великий металлург и изобретатель — Дмитрий Константинович Чернов (1868 год). Именно он сделал важное открытие о полиморфных превращениях и является одним из создателей диаграммы состояния железо-углерод. По мнению Чернова, положение этих точек на диаграмме имеет прямую зависимость от процентного содержания углерода.
И что самое интересное, именно с момента этого открытия и начинает свою жизнь такая наука, как металлография.
Диаграмма сплавов железа с углеродом является результатом кропотливого труда ученных нескольких стран мира. Все буквенные обозначения главных точек и фаз в диаграмме являются интернациональными.
Диаграмма состояния [ править | править код ]
Железо образует с углеродом химическое соединение Fe3C цементит. Так как на практике применяют металлические сплавы на основе железа с содержанием углерода до 5 %, практически интересна часть диаграммы состояния от чистого железа до цементита . Поскольку цементит — метастабильная фаза, то и соответствующая диаграмма называется метастабильной
(сплошные линии на рисунке).
Для серых чугунов и графитизированных сталей рассматривают стабильную
часть диаграммы железо—графит (Fe—Гр), поскольку именно графит является в этом случае стабильной фазой. Цементит выделяется из расплава намного быстрее графита и во многих сталях и белых чугунах может существовать достаточно долго, несмотря на метастабильность. В серых чугунах графит существует обязательно.
На рисунке тонкими пунктирными линиями показаны линии стабильного равновесия (то есть с участием графита), там где они отличаются от линий метастабильного равновесия (с участием цементита), а соответствующие точки обозначены штрихом. Обозначения фаз и точек на этой диаграмме приведены согласно неофициальному международному соглашению.
Элементы диаграммы железо-углерод
Краткая информация о каждом из этих элементов.
Железо – это серебристо-серый металл. Удельный вес — 7, 86 г/см3. Имеет температуру плавления 1539° С.
При взаимодействии железа и других металлов образуются соединения, называемые растворами замещения. Если с неметаллами, например с углеродом или водородом, то — растворами внедрения.
Железо имеет способность, будучи изначально твердым, находиться в нескольких состояниях, которые в металловедении принято называть «альфа» и «гамма». Это качество называется полиморфизмом. Об этом далее в статье.
Углерод – это неметалл. Если он выступает как графит, то температура плавления равна 3500° С. Если как алмаз — 5000° С. Плотность углерода — 2,5 г/см3. Он также обладает полиморфическими свойствами.
В сплавах железо-углерод этот элемент образует твердый раствор, в составе которого есть феррум, называемый цементитом (Fe3C). Также формирует графит в чугунах.
Химические свойства
Как химическое соединение цементит обладает своими физическими, химическими и механическими характеристиками. Он имеет серый кристаллический вид на изломе, относительно твёрдый с высокой термической устойчивостью. Основные химические свойства цементита выражаются в следующих показателях:
- химическая формула Fe3C;
- разложение структуры происходит при температуре более 1650°С;
- подвержен воздействию различных кислот (особенно высоко концентрированных);
- быстро вступает в реакцию с кислородом.
На основании существующих химических свойств сформированы физические и механические свойства. К основным физическим свойствам относятся:
- температура плавления равняется 1700 °С;
- молекулярная масса составляет 179,55 а.е.м.;
- плотность цементита равна 7,7 г/см3 при температуре равной 20 °С.
К основным механическим свойствам относятся:
- твердость;
- стойкость к ударным воздействиям (хрупкость);
- сопротивление на излом;
- пластичность.
Твёрдость этого соединения достигает больших значений и равна НВ 8000 МПа или HRC 70. Однако он обладает достаточной хрупкостью и низкой пластичностью.
Обладая перечисленными свойствами, цементит активно используется при производстве литых деталей различного назначения. Образование различного вида цементита и его соединений с другими формами приводит к изменению характеристик получаемой стали или чугуна, следовательно, к улучшению или снижению отдельных потребительских свойств.
Например, для получения белого чугуна и придания ему высокой прочности и пластичности стараются перевести цементит в графит. Это достигается при проведении операции отжига. При возрастании температуры он распадается на две составляющие: феррит и графит.
В зависимости от требуемых свойств в чугуне стараются сохранить требуемое количество цементита. Особенно это касается так называемого свободной фракции этого соединения. Для снижения его концентрации применяют различные способы химической и термической обработки. Для решения этой задачи применяют раствор азотной кислоты в чистом спирте. Структурно свободный цементит выпадает в осадок в результате кипячения чугунной болванки в этом растворе. Кроме этого применяют три вида обработки: отжиг, нормализацию и закалку.
Техническое железо содержит третичный цементит в сочетании с ферритом. Он проявляется по границе феррита при содержании углерода от 0,01% до 0,025%. Для повышения качества стали стараются снизить содержание свободного цементита. Особенно его концентрация наблюдается в мягких марках стали. Большое влияние на качество штамповки оказывает содержание этой смеси и перлита в единице объёма. Излишнее присутствие третичного цементита, особенно в форме продолжительной цепочки или сетки приводит к образованию разрывов во время штамповки. Поэтому для получения хорошей ковочной стали стараются снизить количество третичного цементита. Структура таких образований не должна превышать второго балла по установленной шкале. Получаемая твёрдость не должна превышать HB 50 единиц.
Диаграмма сплава железо-углерод
В результате взаимодействия составляющих диаграммы друг с другом, получается цементит – химическое соединение.
Как правило, при изучении диаграммы студентами-металловедами, все устойчивые соединения рассматриваются как компоненты, а само графическое изображение исследуется по частям.
Также на занятиях строят кривую охлаждения по диаграмме железо-углерод: выбирается процент углерода, а затем необходимо определить, какая фаза соответствует какой температуре на диаграмме.
Для этого необходимо кроме самой диаграммы начертить систему координат (температура-время). И начиная с максимальных градусов, двигаться постепенно вниз, изображая кривую и участки перехода одной фазы в другую. При этом необходимо называть их и указывать тип кристаллической решетки.
Далее рассмотрим подробнее само графическое изображение диаграммы состояния железо-углерод.
Во-первых, она имеет две формы (части):
- железо-цементит;
- железо-графит.
Во-вторых, сплавы, в которых главными «действующими лицами» является феррум и углерод, условно делят на:
- стали;
- чугуны.
Если углерода в сплаве менее или равно 2,14 % (точка Е на диаграмме), то это сталь, если более 2,14 % – чугун. По этой причине и подразделяют диаграмму на две фазы.
Лекция №3. Железоуглеродистые сплавы
Лекция №3. Железоуглеродистые сплавы
Сплавы железа с углеродом (стали и чугуны) являются наиболее распространенными материалами. Они называются черными металлами и составляют около 95% от производства металлов. Диаграмма состояния железоуглеродистых сплавов дает представление о строении сталей и чугунов.
3.1. Диаграмма состояния железо – углерод
Прежде чем рассматривать превращения в сплавах этой системы, рассмотрим свойства и строение компонентов и фаз системы, а также области их существования.
Компоненты системы Fe – C
. Чистое
железо (Fe)
– серебристо-белый полиморфный металл, с плотностью γ = 7,86г/см3, атомный номер 26, атомный вес 55,85, температура плавления 1539°C, имеет невысокую твердость HB80. При нагреве железо испытывает полиморфные превращения (рис. 1.9) и имеет две полиморфные модификации Feα и Feγ.
Углерод (C)
– неметаллический полиморфный элемент (графит и алмаз), с плотностью 2,25 г/см3.
Фазы системы Fe – C
. Все сплавы комбинируются из трех однофазных и двух двухфазных структурных составляющих.
Однофазные структурные составляющие
.
Феррит
– твердый раствор внедрения углерода в Fα, обозначается Feα(C) – Ф. Максимальная растворимость углерода в феррите достигает 0,02% при 727°С и 0,006% при 20°С. Феррит — это белые по цвету кристаллы, по свойствам он близок к свойствам технически чистого железа. Область существования феррита – QPG.
Аустенит
– твердый раствор внедрения углерода в Feγ. Его обозначают Feγ(C) – A. Хорошо растворяет углерод, при t = 1147°С содержит 2,14% С, а при = 727°С – 0,8%С. Аустенит парамагнитная, пластичная фаза. Область аустенита NJESG.
Цементит
(Ц) – химическое соединение Fe3C- карбид железа, образующийся при содержании углерода 6,67%. Температура плавления 1600°С. Имеет белый, блестящий цвет, хрупкий, твердый. Может быть первичный, вторичный, третичный. Область цементита DFKL.
Имеется еще жидкая фаза, располагающаяся выше линии ликвидус. Железо хорошо растворяет углерод, образуя однородную жидкую фазу – Ж.
Двухфазные структурные составляющие
.
Ледебурит
– эвтектика системы Fe – Fe3C, представляет собой механическую смесь цементита и аустенита и содержит 4,3%С. Кристаллизуется при t = 1147°С, обозначается – Л. Эвтектическая реакция: ЖC↔ ЛC(АE + ЦF). При температуре 727°С происходит эвтектоидное превращение ледебурита, и его структура будет ЛC(ПS + Ц)
Перлит –
эвтектоид системы Fe — Fe3C – механическая смесь, состоящая из мелких пластинок цементита в ферритной основе. Обозначается – П. Перлит образуется из однофазного раствора Feγ(С) при полиморфном превращении Feγ→ Feα при температуре t = 727°С и концентрации углерода 0,8%.
Feγ(C)0,8%→ Fe3C6,67% + Feα(C)0,025%
Железо, взаимодействуя с углеродом, образует ряд химических соединений: Fe3C, Fe2C, FeC и др. Поскольку химическое соединение в диаграммах состояния может быть рассмотрено как компонент, то диаграмму железо-углерод обычно изображают только до содержания углерода 6,67%, при котором образуется карбид железа Fe3C (устойчивое химическое соединение). Поскольку практическое значение имеет только эта часть диаграммы железо-углерод, то этот участок диаграммы называют диаграммой состояния железо – цементит.
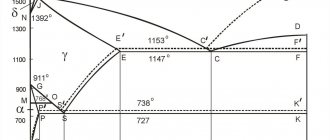
Рис. 3.1. Диаграмма состояния железо – углерод (железо – цементит)
Линия ABCD является линией ликвидус
(S), линия AHJECD-
линией солидус
(L) системы железо-цементит. По линии ECF, при t = 1147°С происходит эвтектическое превращение АE+ ЦF → ЛC, т. е. образуется эвтектика – ледебурит.
По линии PSK происходит эвтектоидное превращение ФP + ЦK → ПS, то есть образуется эвтектоид системы – перлит. К линии PSK аустенит подходит с концентрацией 0,8%С. Если концентрация углерода меньше 0,8%, то по линии GS из аустенита выделяется феррит, если больше – то по линии ES выделяется цементит вторичный – ЦII. Линия PQ – линия переменной растворимости углерода в решетке феррита. Избыточный углерод образует с железом химическое соединение Fe3C – цементит. Чтобы отметить особенности выделения цементита в сплавах с концентрацией углерода менее 0,025% его обозначают цементит третичный – ЦIII. Он выделяется в виде дисперсных включений в зернах феррита, увеличивая его прочность.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы Fe – Fe3C, т. е. критические точки, имеют условное обозначение. Все критические точки обозначаются буквой А. При нагреве к А добавляют букву «с», то есть Ас, а при охлаждении – «r», то есть Ar.
Первая критическая точка А1 лежит на линии PSK (727°С) и соответствует превращению П ↔ А; А2 соответствует температуре 768°С – точка Кюри, А3- линия GS, по которой происходит превращение Ф↔А, температура которого зависит от концентрации углерода в сплаве, Аcm – линия SE – начало выделения ЦII.
Все сплавы системы Fe-Fe3C по структурному признаку делят на две большие группы: стали и чугуны.
Углеродистыми сталями
называют сплавы железа с углеродом до концентрации 2,14%С. Это теоретическое определение. На практике в сталях, как правило, не содержится углерода более 1,5%. Их подразделяют на: доэвтектоидные стали – (содержащие от 0,025% до 0,8%С, Ф + П), эвтектоидную – (0,8%С, П), заэвтектоидные – (0,8%…2,14%С, П + ЦII), рис. 3.2.
а б в
Рис. 3.2. Микроструктуры углеродистых сталей:
а – доэвтектоидная; б – эвтектоидная; в – заэвтектоидная
В доэвтектоидной стали феррит выявляется в микроструктуре в виде светлых полей, а перлит – в виде полей полосчатого (темного) строения (рис.3.2а), где общий светлый фон – феррит, а темные места – тени от выступающих цементитных пластин.
Количество перлита в структуре стали возрастает пропорционально увеличению содержания углерода, это происходит до содержания углерода 0,8%, когда он становится единственной структурной составляющей эвтектоидной стали (рис. 3.2б).
Микроструктура заэвтектоидной стали состоит из перлита и цементита вторичного, который при медленном охлаждении выделяется в виде сетки по границам зерен перлита (рис. 3.2в).
Сплавы железа с углеродом, содержащие углерода больше 2,14% (до 6,67%), называют чугунами
. Их подразделяют на доэвтектические (2,14%…4,3%С, П + ЦII+ Л(П + Ц)), эвтектический (4,3%С, Л(П + Ц)) и заэвтектические (4,3%С…6,67%С, ЦI+ Л(П + Ц)) (рис. 3.3).
а б в
Рис. 3.3. Микроструктуры чугунов:
а– доэвтектический; б – эвтектический; в – заэвтектический
Кроме этого выделяют технически чистое железо (до 0,025%С, Ф + ЦIII).
При охлаждении железоуглеродистых сплавов углерод может не только химически взаимодействовать с железом, но и выделяться в форме графита. Иначе говоря, жидкий раствор, феррит и аустенит могут находиться в равновесии не только с цементитом, но и графитом, и тогда диаграмма состояния будет железо – графит.
Цементит – фаза менее устойчивая, чем графит Г поэтому диаграмма Fe – Fe3C неустойчивая, метастабильная, а Fe – Г – устойчивая. Процесс образования графита носит название графитизация. Графитизация больше проявляется в правой части диаграммы и приводит к образованию половинчатых или серых чугунов, имеющих в своей структуре графит, в отличие от белых чугунов, содержащих в своей структуре только цементит.
3.2. Углерод и постоянные примеси в стали, их влияние на ее свойства
Фазовый состав любой стали в равновесном состоянии – феррит + цементит. Количество цементита возрастает пропорционально росту содержания углерода, и поскольку цементит – твердая, хрупкая фаза, то повышаются прочностные свойства стали (до 0,9%С), твердость, снижаются пластичность и ударная вязкость. С повышением содержания углерода ухудшаются технологические свойства – падают свариваемость, обрабатываемость резанием, деформируемость в горячем и холодном состоянии. На каждые 0,1% С повышается на 20°С порог хладноломкости. Кроме железа и углерода в стали всегда присутствует постоянные примеси.
К постоянным
примесям относятся марганец – Mn, кремний – Si, сера – S, фосфор – P.
Кремний и марганец являются технологическими примесями и находятся в углеродистых сталях в количестве 0,35…0,40% и 0,5…0,8% соответственно. Раскисляя сталь, Si и Mn улучшают её свойства и являются полезными примесями. Растворяясь в феррите, Si и Mn упрочняют его, повышают предел упругости, причем Mn связывает серу и парализует ее вредное влияние.
Сера резко ухудшает свойства стали, выше допустимого предела (0,06%) способна образовывать с железом легкоплавкую эвтектику FeS + Fe и вызывать красноломкость.
Фосфор допускается до 0,045%, растворяясь в феррите, упрочняет его и охрупчивает при низких температурах – резко повышает порог хладноломкости. Сера и фосфор являются вредными примесями.
Кроме постоянных примесей в сплавах железо-углерод имеются скрытые и случайные примеси.
К скрытым
примесям относятся газы (O2, H2, N2), находящиеся в сталях в очень малых количествах. Эти примеси ухудшают пластичность стали.
Случайными
называют примеси цветных металлов (Cu, Pb, Sn, Sb и др.), внесенные в сталь вместе с шихтовыми материалами.
3.3. Классификация и маркировка сталей
По химическому составу
стали могут быть углеродистыми и легированными. Углеродистые содержат железо, углерод и примеси, а легированные содержат дополнительно легирующие элементы, введенные в сталь с целью изменения ее свойств.
По содержанию углерода
углеродистые и легированные стали делят на низкоуглеродистые (до 0,25%С), среднеуглеродистые (0,25…0,7%С) и высокоуглеродистые (более 0,7%С).
По назначению
различают стали конструкционные, идущие на изготовление конструкций, сооружений, деталей машин и инструментальные, идущие на изготовление различного инструмента.
По качеству
конструкционные стали классифицируют на стали обыкновенного качества и качественные. Качество стали определяется совокупностью свойств, определяемых процессом производства, химическим составом, содержащим газов и вредных примесей. В соответствии с ГОСТом стали обыкновенного качества должны содержать не более 0,04% Р и 0,05% S, а качественные -не более 0,035% Р и 0,04% S.
Инструментальные углеродистые стали могут быть качественные и высококачественные (Р, S ≤0,035%).
По раскислению –
в зависимости от степени раскисления при выплавке стали могут быть спокойными (сп), полуспокойными (пс) и кипящими (кп), что и указывают в марке.
По выплавке –
конверторные, мартеновские, электростали.
Углеродистые стали.
Углеродистые конструкционные стали обыкновенного качества а зависимости от назначения и гарантируемых свойств делятся на три группы А, Б и В.
Стали группы А имеют гарантируемые механические свойства. Они используются в состоянии поставки без горячей обработки. Они маркируются буквами Ст. и цифрами, обозначающими порядковый номер марки. Выпускается семь марок сталей этой группы: Ст.0, Ст.1, Ст.2…Ст.6. В зависимости от раскисления ставятся буквы «сп», «пс», «кп». Например, Ст.1сп, Ст.3кп, Ст.5пс. С увеличением номера стали увеличивается содержание углерода (от 0,1 до 0,5% С, исключение – Ст.0 ≈ 0,23% С).
Стали группы Б имеют гарантируемый химический состав. Эти стали подвергаются горячей обработке (ковке, сварке, термообработке, упрочнению ТМО и т. д.). При этом механические свойства не сохраняются, а химический состав важен для определения режима обработки. Они маркируются: БСт. 1… БСт.6.
Стали группы В имеют гарантируемые механические свойства и химический состав и используются, как и сталь группы Б. В марках этой стали на первое место ставится буква В: ВСт.1…ВСт.5. Углеродистая сталь обыкновенного качества – дешевая, ее выплавка составляет около 80 % всего производства углеродистых сталей.
Из сталей Ст.1, Ст.2, Ст. 3 группы А изготавливают крепеж, балки и т.д., из Ст.1,Ст.2,Ст.3 групп Б, В – цементуемые изделия, малонагруженные валы, детали машин, Ст.4 – используют в судостроении, Ст.5, Ст.6 – идут на изготовление средненагруженных деталей (валы, пружины, рессоры, крепеж)
Углеродистые качественные конструкционные стали маркируются двузначными цифрами, указывающими среднее содержание углерода в сотых долях процента и буквами, показывающими степень раскисления стали: сталь 08, сталь 10кп, сталь 20 и т. д. При содержании в стали 0,7- 1% Mn в марке стали добавляется буква Г: 15Г, 30Г, 65Г и т.д. Качественные стали поставляют по химическому составу и по механическим свойствам.
Низкоуглеродистые конструкционные стали это малопрочные, высокопластичные стали, используемые для изготовления малонагруженных и цементуемых деталей, работающих на износ: шестерни, валы, втулки, прокладки и т.д.
Среднеуглеродистые стали более прочные и менее пластичные. Из них изготавливают: шпиндели, штоки, шатуны.
Высокоуглеродистые стали прочные с упругими свойствами, износостойкие. Из них изготавливают наиболее ответственные детали – пружины, рессоры и т.д.
Углеродистые инструментальные качественные стали маркируются буквой «У» и цифрой, обозначающей содержание углерода в десятых долях процента: У7, У8 …У13. В высококачественных сталях в конце марки ставится буква А – У7А.
Легированные стали.
Легированной называют сталь, содержащую специально введенные в нее легирующие элементы с целью изменения строения и свойств. Легирующие элементы могут образовывать с железом твердые растворы – легированный феррит и легированный аустенит, и химическое соединение – легированный цементит или специальные карбиды.
Легированные стали классифицируются:
- по равновесной структуре
: доэвтектоидные стали (с избыточным ферритом), эвтектоидные (перлитная структура) и заэвтектоидные (с избыточным карбидом) – эти стали составляют перлитный класс, ледебуритные, аустенитные, ферритные;
- по составу
: никелевые, хромистые, хромоникелевые и т.д.;
- по назначению
: конструкционные, инструментальные
,
с особыми свойствами; - по количеству легирующих элементов
: низколегированные стали до 5%, среднелегированные – 5…10%, высоколегированные – более 10% легирующих элементов;
- по качеству
: качественные, высококачественные, особовысококачественные;
Маркируются легированные стали с помощью букв и цифр, указывающих примерный химический состав стали.
В конструкционных сталях первые две цифры в марке показывают среднее содержание углерода в сотых долях процента. Далее показывается содержание легирующих элементов. Каждый элемент обозначается своей буквой: Х- хром, Н – никель, Т – титан, Д – медь, Г – марганец, С – кремний, А – азот, К — кобальт, Р – бор, Ф – ванадий, М – молибден, В – вольфрам, Ю – алюминий.
Цифры после буквы указывают примерное содержание этого элемента в процентах. Буква А в конце обозначает, что сталь высококачественная, Ш — особовысококачественная.
В инструментальных сталях содержание углерода указывается одной цифрой и берется в десятых долях; если эта цифра отсутствует, то содержание углерода – более одного процента, легирующие элементы и их количество обозначают как обычно: 9ХС, ХВГ, ХВ5 . Например, сталь 9ХС содержит 0,9% С и примерно по одному проценту хрома и кремния.
Для некоторых групп сталей применяют другую маркировку.
3.4. Классификация и маркировка чугунов
Чугуном называют железоуглеродистые сплавы, содержащие более 2,14%С. В практике машиностроения в большинстве случаев используют чугун с содержанием 2,5…4,0% С.
Чугуны классифицируются по назначению, степени графитизации или структуре, форме графита, микроструктуре металлической основы, химическому составу.
По назначению группы подразделяются на передельные (идут на переработку в сталь) и литейные (для изготовления отливок).
По структуре чугуны подразделяются на белый, серый и половинчатый, в зависимости от формы выделения С.
Белым
называют чугун, в котором при нормальных условиях весь углерод находится в связанном состоянии, главным образом в форме цементита. На изломе у этого чугуна белый цвет и характерный металлический блеск. Наличие большого количества высокотвердого цементита обусловливает высокую хрупкость и плохую обработку резанием. Белый чугун в основном перерабатывают в сталь или при помощи термообработки трансформируют в ковкий чугун, иногда применяют как очень износостойкий материал.
Серым
называют чугун, в котором весь углерод или большая его часть находятся в виде графита, а в связанном состоянии (в форме цементита) углерода содержатся не более 0,8%. На изломе он имеет серый цвет.
В половинчатом
чугуне часть углерода находится в виде графита, но при этом не менее 2%С присутствует в форме цементита.
По форме графита чугун подразделяется на серый
– с пластинчатым графитом различной степени завихренности и толщины пластинок;
ковкий
– с хлопьевидными включениями графита;
высокопрочный
– с шаровидными включениями графита.
По структуре металлической основы чугуны подразделяются на ферритные
,
ферритно-перлитные
и
перлитные
.
По химическому составу чугуны подразделяются на нелегированные, низко-, средне- и высоколегированные, содержащие соответственно 3…3,5%, 7…10% и более 10% легирующих элементов.
В промышленном чугуне кроме углерода обязательно содержатся кремний, марганец, сера и фосфор.
Кремний способствует графитизации чугуна и специально добавляется, его содержание в чугунах от 0,5% до 4,5%.
Марганец препятствует графитизации и способствует получению в структуре Fe3С, содержание Мn в чугунах от 0,4 до 1,3%.
Сера является нежелательным элементом, она снижает жидкотекучесть, отбеливает чугун. Содержание S допускается не более 0,08…0,12%.
Фосфор – полезная примесь, улучшает жидкотекучесть, увеличивает твердость и износостойкость чугуна. Содержание P – 0,3…0,8%.
На структуру чугуна кроме углерода и кремния существенно влияет скорость охлаждения отливок. При быстром охлаждении получается белый чугун, при медленном – серый. Наибольшее применение находит серый чугун.
Серый чугун
содержит до 3,8%С, при этом в форме цементита находится не более 0,8%С, а остальной углерод находится в виде графитовых пластинок – чешуек.
Металлической основой серого чугуна может быть Φ, Φ+Π, Π, при этом структура не влияет на пластичность серого чугуна (все равно низкая), но оказывает влияние на его твердость и прочность.
Графит имеет низкую механическую прочность, и места его залегания можно рассматривать как внутренние надрезы, трещины, нарушения сплошности. Чем больше графита и чем крупнее включения, тем ниже механические характеристики. Для измельчения включений графита проводят модифицирование жидкого чугуна путем добавления в него силикокальция, алюминия и ферросилиция.
Серый чугун широко применяют в машиностроении. Это дешевый металл с хорошими литейными свойствами. Он легко обрабатывается режущим инструментом, обладает хорошими антифрикционными и демферирующими свойствами.
Рис. 3.4. Влияние металлической основы и формы включений
графита на свойства чугуна
Серые чугуны маркируются буквами СЧ (серый чугун) и цифрами, показывающими предел прочности при растяжении (временное сопротивление при растяжении σв). Например: СЧ12, СЧ18, СЧ21, СЧ36, СЧ40 и т.д.
Чугуны СЧ12 – СЧ18 используют для изготовления неответственных деталей: крышек, корпусов подшипников, фундаментных плит и т.п.
Чугун, начиная с СЧ21, используют для изготовления станин мощных станков, ответственных деталей, зубчатых колес и т.п.
При быстром охлаждении отливок графитизация может произойти только в середине отливки, а поверхность приобретает структуру белого или половинчатого чугуна. Такие отливки из серого чугуна называют отбеленными, они обладают хорошим сопротивлением износу, из них изготавливают валки и шары для мельниц, тормозные колодки и т.д.
Высокопрочный чугун
содержит около 3,0…3,6%С. Его получают добавлением в жидкий чугун магния (0,03…0,07%) или других щелочных или щелочноземельных металлов. При этом выделяющийся графит приобретает шаровидную форму, такой графит меньше ослабляет металлическую основу, и механические свойства чугуна улучшаются – повышается его пластичность и увеличивается твердость. Металлическая основа высокопрочного чугуна также может быть различной: Ф, Ф+П, П.
Высокопрочные чугуны маркируются буквами ВЧ и цифрами, показывающими предел прочности при растяжении в кгс/мм2 и относительное удлинение в %, например: ВЧ38-47, ВЧ40-10, ВЧ50-2,5, ВЧ60-2 и т.д.
Из высокопрочных чугунов изготавливают оборудование прокатных станов, кузнечно-прессовое оборудование, корпуса двигателей внутреннего сгорания, крупные валы и другие ответственные детали.
Ковкий чугун
содержит: 2,2…3,0%С, 0,7…1,5%Si, 0,2…0,6%Mn, менее 0,2%Р и менее 0,1%S. Термин «ковкий чугун» является условным и отражает повышенную пластичность этого чугуна при растяжении по сравнению с другими видами.
Ковкий чугун получают путем отжига отливок из белого чугуна, в результате чего цементит распадается и графит выделяется в виде хлопьев.
При отжиге изделия из белого чугуна нагревают выше температуры А1(950…1000°С), выдерживают около 15 часов, медленно охлаждают в течение 30 часов в зоне А1 (температуры эвтектоидного превращения) с 760°С до 720°С и затем охлаждают до комнатной температуры.
Рис. 5.4. Схемы отжига белого чугуна на ферритный (1) и перлитный (2) ковкие чугуны
При t = 950°С происходит распад цементита Fe3С →3Fe + Г, а затем при t = 760…720°С – распад аустенита А→ Ф + Г.
В результате всех превращений структура ковкого чугуна будет состоять из зерен Ф и равномерно распределенных хлопьев Г. Поскольку в таком чугуне находится довольно много графита, излом получается темным и его называют черносердечным
(Ф + Г) – ковкий ферритный чугун.
Если в области эвтектоидного превращения скорость охлаждения будет выше, то у чугуна возможна структура перлита и графита, т.е. П + Г, такой чугун называют ковким перлитным чугуном, или светлосердечным
.
Ковкий чугун маркируют буквами КЧ и цифрами предела прочности и относительного удлинения, например: КЧ30-6, КЧ50-4, КЧ60-3 и т.д.
Из ковких ферритных чугунов изготавливают как изделия, работающие при высоких статических и динамических нагрузках (картеры редукторов, ступицы, кроки), так и менее ответственные детали (хомуты, гайки, фланцы муфт).
Из ковкого перлитного чугуна делают вилки карданных валов, звенья и рамки конвейеров, втулки, тормозные колодки.
Ковкий чугун применяют для деталей небольшого сечения, работающих при ударных и вибрационных нагрузках.
Легированные
и
специальные
чугуны получают введением присадок легирующих элементов. В качестве присадок применяют Cr, Ti, V и др. Специальные чугуны отличаются содержанием кремния и марганца.
Маркируются чугуны по-разному, например, антифрикционные: АЧС-1, АЧК-1, АЧВ-1 или АЧС-2, АЧК-2 и т.д., кремнистые (14-18% Si): С-15, С-17, жаростойкие: ЖЧХ-20 (20% Cr), ЖЧХ-22 и т.д.
Полиморфные превращения
Более подробно о каждой фазе чуть ниже в статье. А если кратко, то осуществление главных превращений происходит при особых температурах.
Состояние железа обозначают как α-феррум (при температуре менее 911° С) . Кристаллическая решетка – объемный гранецентрированный куб. Или ОЦК. Дистанция между атомами такой решетки достаточно высокая.
Железо приобретает модификацию гамма, то есть обозначается как γ-феррум (911-1392° С) . Кристаллическая решетка — гранецентрированный куб (ГЦК). В этой решетке дистанция между атомами ниже, чем в ОЦК.
При переходе α-феррума в γ-феррум объем вещества становится меньшим. Причиной тому является кристаллическая решетка – ее вид. Потому что решетка ГЦК имеет более упорядоченное состояние атомов, чем ОЦК.
Если переход осуществляется в обратном направлении — из γ-феррума в α-феррум, то объем сплава увеличивается.
Когда температура достигает значения 1392° С (но менее температуры плавления железа 1539° С), то α-феррум превращается в δ-феррум, но это не является ее новой формой, а лишь разновидностью. К тому же δ-феррум является неустойчивой структурой.
Физика 8 класс. Плавление и кристаллизация
Физика 8 класс Конспект ПлавлениеПлавление и кристаллизация. Удельная теплота плавления.
Задачи на тему Тепловые явления
Переход вещества из твердого состояния в жидкое называется плавлением.
Плавление кристаллических тел происходит только при определенной температуре.
Температуру, при которой вещество плавится, называют температурой плавления вещества.
Чтобы провести процесс плавления, сначала надо нагреть твердое тело до температуры плавления.
Если тело нагреть до температуры плавления и убрать нагреватель (перестать подводить тепло к телу) — то плавления не происходит.
Чтобы осуществить плавление тела, надо выполнить два условия: 1. нагреть тело до температуры плавления 2. продолжить передачу теплоты
Температура плавления — важная тепловая характеристика вещества. У разных веществ температура плавления различна.
Плавление металла
Переход вещества из жидкого состояния в твердое называют отвердеванием или кристаллизацией.
Чтобы началась кристаллизация расплавленного (жидкого) тела, оно должно остыть до определенной температуры.
Температура, при которой вещество отвердевает (кристаллизуется), называют температурой отвердевания или кристаллизации.
График плавления и отвердевания кристаллических тел.
График плавления и отвердевания
Опыт показывает, что вещества отвердевают при той же температуре, при которой плавятся.
Чтобы осуществить процесс отвердевания нужно выполнить два условия: 1. охладить жидкость до температуры отвердевания (плавления) 2. продолжать отводить тепло до тех пор, пока вся жидкость не отвердеет.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления обозначают буквой λ, измеряют в Дж/кг.
Чтобы вычислить количество теплоты Q, необходимое для плавления кристаллического тела массой m, взятого при его температуре плавления и нормальном атмосферном давлении,
нужно удельную теплоту плавления λ умножить на массу тела:
где Q– количество теплоты, m– масса тела.
Температура плавления и кристаллизации для данного вещества при неизменном внешнем давлении равны.
Кристаллизация
Количество теплоты, выделяющееся при кристаллизации вещества, при неизменном внешнем давлении равно количеству теплоты, полученному этим веществом при плавлении.
Задачи
Испарение и конденсация
Конспект составлен на основании теоретического материала учебника «Физика 8 класс» А.В. Перышкин, «Физика 8 класс»А.В.Грачев.
Скачать конспект:
teoriya_8_plavleniekristallizacziya
Физика 8 класс. Количество теплоты. Удельная теплоемкость. Топливо.
Физика 8 класс. Кипение. Конденсация.
Физика 8 класс. Испарение. Насыщенный пар. Влажность воздуха.
Физика 8 класс. Тепловые явления. Внутренняя энергия.
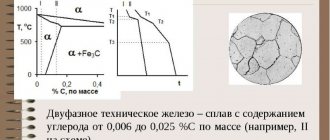
Свойства технически чистого железа
Магнитные свойства железа при различных температурах:
- менее 768° С – ферромагнитно;
- более 768° С – парамагнитно.
А температурную точку 768° С называют точкой магнитного превращения, или точкой Кюри.
Свойства технически чистого железа:
- твердость – 80 НВ;
- временное сопротивление — 250 МПа;
- предел текучести – 120 МПа;
- относительное удлинение 50 %;
- относительное сужение – 80 %;
- высокий модуль упругости.
Карбид железа
Графический вид составляющей части диаграммы железо-углерод: Fe3C. Вещество называется карбидом железа, или цементитом. Для него характерно:
- Содержание углерода 6,67 %.
- Удельный вес — 7,82 %.
- Кристаллическая решетка имеет ромбическую форму, состоящую из октаэдров.
- Плавление происходит при температуре ≈1260° С.
- Низкие ферромагнитные свойства при пониженной температуре.
- Твердость – 800 НВ.
- Пластичность практически равна нулю.
- Карбид железа образует твердые растворы замещения, в которых атомы углерода замещаются атомами неметаллов (азотом), а атомы железа – металлами (хромом, вольфрамом, марганцем). Этот твердый состав называется легированным.
Как уже отмечалось выше, цементит – это нестабильная фаза, а графит – стабильная. Поскольку первое вещество представляет собой неустойчивое соединение, распадаясь при определенных температурных условиях.
В диаграмме железо-углерод есть такие состояния:
- жидкая фаза;
- феррит;
- аустенит;
- цементит;
- графит;
- перлит;
- ледебурит.
Рассмотрим каждую из них подробно.
Феррит
Является твердым раствором внедрения углерода в α-ферруме. Также может быть включено небольшое количество примесей. Но феррит имеет почти одинаковые качества, как и чистое железо. Если рассмотреть структуру под микроскопом, то можно увидеть полиэдрические зерна светлого тона.
Бывает:
- низкотемпературный (при температуре 727° С растворимость углерода 0,02 %);
- высокотемпературный (при 1499° С растворимость углерода 0,1 %), или его называют δ-феррум.
Свойства феррита:
- твердость — 80-120 НВ;
- временное сопротивление — 300 МПа;
- относительное удлинение — 50 %;
- обладает хорошими магнитными свойствами (до температуры 768° С).
Строение и свойства
При повышении температуры аустенитные стали превращаются в жидкий раствор с определённым процентным отношением железа и углерода. Если температура раствора превышает линию так называемого ликвидуса (это около 1700 °C),образовавшийся расплав становится статически неустойчивым. Его состояние оценивают по двум составляющим:фазовой и структурной.
Для первой составляющей основным показателем является фаза состояния полученной смеси. Она определяет состояние металла по следующим показателям:
- раствора углерода в железе;
- количество различных образований (непосредственно феррит, в том числе высокотемпературный, аустенит, цементит).
Структурная составляющая часть образца определяется как гомогенная или квазигомогенная форма. Общая структура образовавшегося феррита составляет равноосные кристаллы. В трёхмерном пространстве решётка ферритной фазы представляет объёмно-центрированный куба. Эти кристаллы определяют твёрдость феррита и способность углерода в нём растворяться. Опыт показывает, что при температуре равной 727 градусов в феррите растворяется только 0,02% углерода.
Кроме этого к основным свойствам феррита относятся:
- обладает сильными ферромагнитными свойствами (до температуры 770 °С — точка Кюри);
- является теплопроводным элементом;
- хорошим проводником электрического тока;
- обладает повышенной пластичностью.
К основным недостаткам относятся невысокая прочность и недостаточная твёрдость. Последний показатель зависит от величины образованного зерна и находится в интервале от 65 до 130 НВ.
В зависимости от этапа проходящих превращений ферритная фаза находится в следующих состояниях:
- как основа кристаллической решётки образовавшегося сплава;
- второе или избыточное состояние (располагается по границам так называемых перлитных образований);
- элемент феррито-графитного эвтектоида.
Каждое состояние требует точного определения и выявления возникающих преобразований. От них во многом зависят характеристики конечного продукта.Полное отсутствие ферритного образования или незначительное его содержание проявляется с образованием горячих трещин. Завышенное содержание этого показателя снижает пластичность, ударную вязкость и антикоррозийную стойкость.
Аустенит
Это твердый раствор внедрения углерода в γ-ферруме. Также могут быть в небольшом количестве примеси. В кристаллической решетке углерод находится в центре ГЦК ячейки. При рассмотрении структуры аустенита под микроскопом, виден как светлые зерна полиэдрической формы с двойниками.
Обладает следующими характеристиками:
- Растворимость углерода в γ-ферруме 2,14 % (при температуре 1147° С).
- Твердость аустенита 180 НВ;
- Удлинение — 40-50 %;
- Хорошие парамагнитные качества.
Цементит и его формы
Присутствует в таких фазах: Ц1, Ц2, Ц3 (первичный, вторичный и третичный цементит).
Что касается физико-химических показателей этих трех состояний, то они приблизительно равны. На механические свойства влияет размер частиц, их количество и расположение.
Также по диаграмме видно, что:
- Ц1 образуется из жидкого состояния (под микроскопом он виден как пластины крупной величины);
- Ц2 – из аустенита (располагаясь вокруг его зерен в виде сетки);
- Ц3 – из феррита (располагаясь у границ ферритных зерен в виде мелких частиц).
Описание
Концентрация углерода в цементите — 6,67% по массе — предельная для железоуглеродистых сплавов. Цементит — метастабильная фаза; образование стабильной фазы — графита во многих случаях затруднено. Цементит имеет орторомбическую кристаллическую решётку, очень твёрд и хрупок, слабо магнитен до 210 °C.
В зависимости от условий кристаллизации и последующей обработки цементит может иметь различную форму — равноосных зёрен, сетки по границам зёрен, пластин, а также видманштеттову структуру.
Цементит в разных количествах, в зависимости от концентрации, присутствует в железоуглеродистых сплавах уже при малых содержаниях углерода. Формируется в процессе кристаллизации из расплава чугуна. В сталях выделяется при охлаждении аустенита или при нагреве мартенсита. Цементит является фазовой и структурной составляющей железоуглеродистых сплавов, составной частью ледебурита, перлита, сорбита и троостита. Цементит — представитель так называемых фаз внедрения, соединений переходных металлов с лёгкими металлоидами. В фазах внедрения велики доля как ковалентной, так и металлической связи.
Твёрдость по Бринеллю больше 800 кг/мм2. Первичный цементит кристаллизуется из жидкого сплава Вторичный цементит — из аустенита Третичный цементит — из феррита
Это интересно: Цементация стали в домашних условиях графитом и другими методами — разбираем досконально
Чугуны
Сплавы на диаграмме железо-углерод, которые содержат углерода более, чем 2,14 %, называются чугунами. Они обладают высокой хрупкостью. Поперечное сечение такого чугуна имеет светлый тон, а потому его называют белым чугуном.
На диаграмме это точка С, называемая эвтектикой, с соответствующим содержанием углерода 4,3 %. При кристаллизации образуется смесь, состоящая из аустенита и цементита, в совокупности называемая ледебуритом. Фазовый состав постоянен.
При концентрации углерода менее 4,3 % (доэвтектический чугун) при кристаллизации выделяется аустенит из раствора. Далее из него выделяется Ц2. А при 727° С аустенит превращается в перлит. Структурное состояние такого чугуна следующее: крупные участки перлита темного тона.
В заэвтектическом белом чугуне (углерода более 4,3%) при охлаждении структурирование происходит с образованием кристаллов Ц1. Далее превращения осуществляются уже в твердом состоянии. Структура представляет собой ледебурит, который является фоном для полей перлита темного тона. А крупные пласты – это Ц1.
Фазы в системе “железо-углерод”
Фазы – это физически однородные состояния сплава. Фаза имеет точный химический состав – определенное расположение и связь между атомами. Такая структура атомов придает разные свойства различным фазам.
Некоторые специальные сплавы могут существовать в нескольких фазах, что достигается нагревом металла до определенных температур и использованием разных процедур термообработки.
Жидкая
Существует при температуре, которая превышает 1457 oC. Фазовое превращение при этой температуре означает полное плавление, поэтому на диаграмме жидкая фаза всегда обозначается линией L.
Феррит
На диаграмме присутствует в трёх разных фазах:
- Фаза дельта-феррита (δ-Fe) представляет собой твердый раствор C в δ-Fe (ОЦК) в высокотемпературной области диаграммы. Раствор стабилен при температуре выше 1400 °C и плавится при температуре выше 1539 °C. Структурно подобен α-ферриту;
- Фаза гамма-феррита (γ-Fe) является твёрдым раствором C в γ-Fe, который называют аустенитом. Нестабилен ниже температуры 910 °C, превращаясь в δ-феррит при 1395 ° C.. Максимальная растворимость углерода составляет около 2,1% при 1147 °C. Аустенит мягок и пластичен, не обладает магнитными свойствами;
- Фаза альфа-феррита (α-Fe) представляет собой твердый раствор C в α-Fe с ОЦК-решёткой. Считается самой стабильной формой железа при комнатной температуре. Максимальная растворимость углерода составляет около 0,02% при 727 °C. Мягче аустенита, магнитен.
Аустенит в сталях
Аустенит всегда присутствует в нержавеющих сталях, которые содержат от 16 до 26 процентов хрома и до 35 процентов никеля. Аустенитные стали, помимо высокой коррозионной стойкостью, не закаливаются при термической обработке и немагнитны.
Формы существования цементита важны для определения коррозионной стойкости сталей. Доказано, что цементит (Fe3C) увеличивает скорость коррозии, причём этот эффект более выражен, когда он образует когерентную сеть на поверхности. В нормализованных сталях цементит образует когерентную сетку, а в отпущенном мартенсите – нет. Поэтому цементит влияет на скорость коррозии нормализованной, но не закалённой стали.
В целом скорость коррозии углеродистой стали снижается с увеличением содержания хрома из-за образования защитного оксида хрома. Однако, когда хром соединяется с углеродом с образованием карбида хрома, положительный эффект хрома теряется.