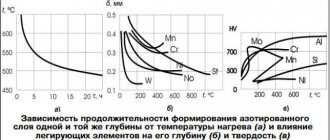
Медный факел
Зная, что некоторые металлы окрашивают пламя, сделайте медный «факел». Это необыкновенно интересный опыт. Соберите аппаратуру, показанную на рисунке.
Всыпьте в пробирку несколько криеталликов какой-либо соли меди, например, CuSO4 (медный купорос), и добавьте до 1/3 высоты пробирки денатурат и несколько капель разбавленной соляной кислоты Закупорьте пробирку пробкой, через которую проходит трубка, изогнутая под прямым углом и суженая на конце. Поместите пробирку в химический стакан с горячей водой, денатурат начнет испаряться, увлекая с собой соль меди. Приставьте к выходу трубки горящую спичку: пары денатурата зажгутся, а пламя приобретет зелено-синий цвет. Эффект опыта необыкновенно красив, если его наблюдать в темной комнате.
А теперь модифицируйте опыт, взяв вместо соли меди ранее употреблявшиеся химические соединения, окрашивающие пламя. А если у вас есть бура или борная кислота, проверьте, как окрашивает пламя бор. Борную кислоту можно купите в аптеке. И еще одно: не заливайте пробирку более чем на 1/3 высоты. И ни в коем случае не нагревайте пробирку горелкой!
Измерение спектра пламени костра
Были проведены классические эксперименты — измерены спектры Солнца, лазеров, пламени газовой горелки и всевозможных ламп. Спектрометр прошел проверку и теперь можно было приступать к исследованию пламени костра.
Исследуемое пламя костра в камине
Я разжигал костер в камине и проводил исследования, фиксируя спектр пламени
Измерим спектр линии огня — так я назвал увиденную линию.
На фоне очень слабого непрерывного черно-тельного спектра были зарегистрированы две яркие желтые лини с длинами волн 589,0 нм и 589,6 нм. Согласно базе данных NIST — это линии натрия.
Спектры калибровочной лампы, костра в камине, поваренной соли и золы из камина
Ниже на фотографии показана часть спектра пламени костра с большим увеличением, чтобы можно было рассмотреть двойную линию натрия 589,0 нм и 589,6 нм на фоне непрерывного спектра раскаленных частиц углерода:
Крупным планом спектральные линии натрия в костре и линии натрия в золе, горящей в спирте.
В дальнейших исследованиях была зафиксирована динамика появления линий натрия в спектре. Пока костер разгорается — в спектре линии отсутствуют. По мере появления углей и увеличения мощности излучения, данные линии появляются и их яркость растет.
Цветные свечи
Чтобы получить свечи с разноцветным пламенем надо добавить в расплавленный парафин соль металла, окрашивающего пламя в той или иной цвет.
Синяя свеча. Покрасить парафин в синий цвет можно стеаратом меди. Эту соль получают смешивая растворы сульфата меди и хозяйственного мыла. Пламя свечи тоже будет синим, благодаря ионам меди.
Зеленая свеча. В качестве пигмента используется зеленый оксид хрома (III). Он получается при термическом разложении бихромата аммония (опыт с вулканом). Цвет пламени тоже будет зеленым.
Желтая свеча. Желтый хромат натрия окрасит парафин и пламя свечи в желтый цвет.
Красная свеча. Парафин подкрашивают любым красным пигментом, например гуашью. Чтобы пламя было красным надо добавитькакую-либо соль стронция или лития.
Библиография
- Кшиштоф Кушмерчик, журнал «Горизонты техники для детей» 1989-3
Применение калия
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация различных ферментов.
- Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Электронная оболочка
Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Нахождение в природе
Ввиду высокой химической активности калий в свободном состоянии в природе не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т. д. Также калий входит в состав минералов сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль
). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Средняя концентрация в морской воде — 380 мг/л.
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ПАО «Уралкалий», г. Березники, г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд).
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе 2.1 Месторождения
- 5.1 Взаимодействие с простыми веществами
- 6.1 Важные соединения
- 7.1 Калий в организме человека
История и происхождение названия
Соединения калия используются с древнейших времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия K2CO3, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
19 ноября 1807 года в Бейкеровской лекции английский химик Дэви сообщил о выделении калия электролизом расплава едкого кали (KOH)(в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года). Дэви назвал его «потасий»
(лат. potasium; это название (правда, в некоторых языках с двумя буквами
s
) до сих пор употребительно в английском, французском, испанском, португальском и польском языках. При электролизе влажного едкого кали KOH на ртутном катоде он получил амальгаму калия, а после отгонки ртути — чистый металл. Дэви определил его плотность, изучил химические свойства, в том числе разложение воды и поглощение водорода.
В 1808 году французские химики Гей-Люссак и Л. Тенар выделили калий химическим путём — прокаливанием KOH с углём.
В 1809 году немецкий физик Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали
— поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.