- Место в таблице Менделеева
Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без
кислородаи водороданемыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебыдо человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары
фосфоранад прокаленным мелом. В результате этой химической реакцииобразовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.
Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Строение атомов углерода
В атоме углерода 6 электронов, из них на внешнем электронном слое находится 4 электрона (см. рис. 32):
До завершения внешнего электронного слоя атому углерода не хватает 4 электронов. Поэтому в своих соединениях с металлами и водородом атомы углерода проявляют отрицательную степень окисления, равную –4, например — карбид алюминия.
В соединениях с более электроотрицательными элементами атомы углерода проявляют положительные степени окисления +4 и +2, например — углекислый газ и CO — угарный газ.
Строение и физические свойства простых веществ
Так же как кислород, сера и фосфор, углерод образует несколько аллотропных модификаций. Наиболее известные из них графит и алмаз.
Графит — темно-серое вещество, состоящее из атомов углерода, которые расположены послойно (рис. 88). Эти слои относительно слабо связаны друг с другом, поэтому графит мягкий и может быть разделен на отдельные чешуйки. На способности графита оставлять черту при трении основано его широкое использование для производства карандашей.
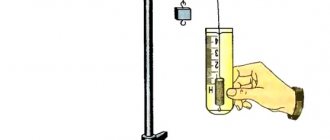
Cажа, древесный уголь, получаемый при нагревании древесины без доступа воздуха, и кокс, получаемый из каменного угля, — это продукты с высоким содержанием углерода. Древесный уголь обладает способностью поглощать (адсорбировать) пары, газы и вещества из жидких растворов. Это объясняется тем, что он имеет большое количество пор и, следовательно, обладает большой поверхностью. Поместим в стакан с раствором лакмуса истолченный древесный уголь (рис. 89). Через некоторое время жидкость в стакане обесцветится, так как уголь поглотит лакмус.
Сорбционные свойства древесного угля широко применяются в противогазах, в химической промышленности, для обесцвечивания и очистки сахарного сиропа, масла, жиров, вин, питьевой воды, а также в медицине.
В отличие от графита в алмазе (рис. 90) каждый атом углерода связан с другими атомами четырьмя химическими связями, направленными к вершинам тетраэдра. Все связи между атомами углерода одинаковые, небольшие по длине и очень прочные. Поэтому алмаз является самым твердым природным веществом. Алмаз образует прозрачные, сильно преломляющие свет кристаллы. Ограненные алмазы называются бриллинтами.
Графит хорошо проводит электрический ток, а алмаз является изолятором.
Известны и другие аллотропные модификации углерода: карбин, фуллерены, графен. С ними вы познакомитесь в курсе химии 11-го класса.
В том, что разные аллотропные модификации углерода состоят из атомов одного и того же элемента, можно убедиться, сжигая их в кислороде. Все они при горении образуют один и тот же продукт — оксид углерода(IV) и ничего больше. Кроме того, равные массы графита, алмаза, карбина и фуллерена дадут одно и то же количество углекислого газа.
В конце XVIII в. известный французский химик Лавуазье вместе со своими коллегами купил небольшой алмаз и сжег его в громадной «зажигательной машине» (см. рис.) с помощью сфокусированных солнечных лучей. При этом образовался только один продукт — углекислый газ СО2. Этот же газ Лавуазье получил и при сжигании древесного угля. Данные опыты позволили ученому сделать вывод, что алмаз и уголь имеют «одно начало».
В определенных условиях возможно превращение одной модификации углерода в другую. Так, при сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит при температуре выше 2000 °С и давлении порядка 100 000 атм превращается в алмаз. Этот процесс используется для получения искусственных алмазов, нашедших техническое применение.
При записи уравнений химических реакций различные модификации углерода обозначаются буквой С.
Химические свойства углерода
Углерод реагирует с другими веществами, как правило, при нагревании.
Окислительные свойства углерода проявляются при его взаимодействии с металлами при высокой температуре:
Получаемые соединения называются карбидами.
Углерод проявляет восстановительные свойства при взаимодействии с кислородом, образуя при недостатке кислорода оксид углерода(II):
или при его избытке — оксид углерода(IV):
Восстановительные свойства углерода проявляются и в реакциях со сложными веществами. Так, при взаимодействии углерода с оксидом железа(III) получают металлическое железо:
Это один из самых первых химических процессов, освоенных человеком.
- Из аллотропных модификаций углерода наиболее известны графит и алмаз.
- При взаимодействии с другими веществами углерод может проявлять как восстановительные, так и окислительные свойства.
Оксиды углерода
Среди неорганических соединений углерода наибольшее значение имеют его кислородные соединения: оксиды, угольная кислота и ее соли.
Оксид углерода(II)
Модель молекулы оксида углерода(II) представлена на рисунке 91. Он относится к несолеобразующим оксидам, так как не взаимодействует в обычных условиях ни с кислотами, ни со щелочами.
Оксид углерода(II) СО образуется при неполном сгорании топлива (дров, торфа, угля) и может попадать в воздух. При вдыхании человеком такого воздуха наступает отравление (угар), поэтому СО называют угарным газом. Угарный газ содержится также в табачном дыме и выхлопных газах автомобилей. Оксид углерода(II) — сильный яд! При вдыхании он связывается с гемоглобином крови прочнее, чем кислород, и тем самым блокирует перенос кислорода в организме. Возникает кислородное голодание, сопровождающееся головной болью и потерей сознания. При сильном отравлении возможен смертельный исход. Человека, пострадавшего от угарного газа, надо как можно быстрее вынести на свежий воздух и оказать медицинскую помощь.
Оксид углерода(II) горит на воздухе голубоватым пламенем с выделением большого количества теплоты, превращаясь в углекислый газ:
В этой реакции оксид углерода(II) проявляет восстановительные свойства.
Восстановительные свойства оксида углерода(II) проявляются и в его реакциях с оксидами металлов. Продуктами этих реакций являются металл и углекислый газ:
Эта реакция используется в промышленности для получения металлов из руд.
Оксид углерода(II) служит исходным сырьем для получения большого количества органических веществ. В то же время он является одним из наиболее опасных загрязнителей атмосферного воздуха.
Оксид углерода(IV)
С оксидом углерода(IV), или углекислым газом вы уже знакомы. Модель молекулы и графическая формула этого оксида показаны на рисунке 92.
Молярная масса примерно в 1,5 раза больше средней молярной массы воздуха (29 г/моль), поэтому углекислый газ тяжелее воздуха. Углекислый газ не поддерживает дыхание, поэтому в его атмосфере животные и человек погибают от отсутствия кислорода.
При охлаждении или при повышенном давлении углекислый газ затвердевает, образуя белое кристаллическое вещество, напоминающее снег («сухой лед»). В таком виде он широко используется как охлаждающее средство для хранения скоропортящихся продуктов, например мороженого.
Углекислый газ может быть получен при взаимодействии углерода с кислородом при нагревании:
Оксид углерода(IV) образуется при сжигании различных органических веществ (метана, спирта, угля и др.). Реакция сопровождается выделением большого количества теплоты, поэтому сжигание этих веществ используют для получения тепловой энергии. Углекислый газ образуется также при дыхании живых организмов и при гниении.
В промышленности оксид углерода(IV) получают обжигом известняка
В лаборатории можно получить действием кислот на карбонаты, например на карбонат кальция (рис. 93):
Углекислый газ является кислотным оксидом, он незначительно растворяется в воде, образуя при этом слабую угольную кислоту:
Именно этим обусловлен кислый вкус газированных и некоторых минеральных вод.
C основными оксидами и щелочами образует соли угольной кислоты — карбонаты:
При пропускании через раствор гидроксида кальция (известковую воду) раствор мутнеет и выпадает осадок карбоната кальция (рис. 94):
Эта реакция является качественной на углекислый газ.
Для оксида углерода(II) характерны восстановительные свойства.
Оксид углерода(IV) — углекислый газ является кислотным оксидом. При растворении в воде он образует слабую угольную кислоту.
Углекислый газ взаимодействует с основными оксидами и с основаниями.
Угольная кислота и ее соли
В молекуле угольной кислоты атом углерода соединен с тремя атомами кислорода одной двойной связью и двумя одинарными связями С—ОН. Модель молекулы и графическая формула угольной кислоты представлены на рисунке 95.
В водных растворах угольная кислота представляет собой очень непрочное вещество. При попытке выделить ее из раствора она практически полностью разлагается на углекислый газ и воду:
В то же время раствор в воде слегка кисловат на вкус, а при добавлении в раствор лакмуса окрашивается в розовый цвет. Поэтому раствор оксида углерода(IV) в воде можно считать раствором угольной кислоты.
В 2011 г. исследователи из Технического университета Вены и Университета Инсбрука (Австрия) получили угольную кислоту в виде твердого белого вещества, устойчивого на воздухе при температурах ниже –30 °С.
Угольная кислота является слабой двухосновной кислотой, в водном растворе диссоциирует ступенчато. На первой ступени диссоциации образуются ион водорода и гидрокарбонат-ион
Приставка гидро- в названии кислотного остатка указывает на наличие в его составе атома водорода. Соли, содержащие такой кислотный остаток, относятся к так называемым кислым солям и называются гидрокарбонатами.
На второй ступени гидрокарбонат-ион диссоциирует с образованием иона водорода и карбонат-иона
Соли, содержащие карбонат-ион, являются средними и называются карбонатами.
Химические свойства солей угольной кислоты
Соли угольной кислоты, кроме карбонатов большинства щелочных металлов, при нагревании разлагаются с выделением углекислого газа:
Карбонаты и гидрокарбонаты как соли очень слабой кислоты взаимодействуют со всеми более сильными кислотами с выделением углекислого газа. Если капнуть на кусочек мела, который представляет собой карбонат кальция, раствор соляной кислоты, то наблюдается характерное вскипание из-за бурного выделения углекислого газа (рис. 96):
Такое испытание можно проводить и с твердыми карбонатами, и с их растворами. Приведенную реакцию рассматривают как качественную реакцию для определения карбонат-ионов.
Для растворимых карбонатов уравнение качественной реакции на ионы можно записать в сокращенной ионной форме:
Карбонатами можно пользоваться для нейтрализации кислот, так как при их взаимодействии с кислотами происходит связывание ионов водорода. Например, размолотый известняк, состоящий в основном из CaCO3, и доломитовую муку (CaCO3 MgCO3) вносят в почвы при их излишней кислотности. Аналогичную роль выполняет и древесная зола из-за содержащегося в ней карбоната калия.
Превращения карбонатов и гидрокарбонатов
Если пропустить углекислый газ через раствор гидроксида кальция (см. рис. 94), то будет наблюдаться помутнение раствора за счет выпадения осадка:
При дальнейшем пропускании углекислого газа твердые частицы карбоната кальция будут растворяться и жидкость снова станет прозрачной. Образуется растворимый в воде гидрокарбонат кальция:
При нагревании гидрокарбонат кальция превращается в карбонат:
В природе протекание процессов с участием углекислого газа, воды и известняка, мела, мрамора (все эти вещества по химическому составу представляют собой CaCO3) приводит к их постепенному растворению за счет превращения в гидрокарбонат. В результате в земной коре появляются огромные полости, пещеры. Гидрокарбонат кальция переходит в карбонат кальция, образующий сталактиты и сталагмиты (см. рис.).
Применение солей угольной кислоты
Одной из наиболее широко применяемых солей угольной кислоты является карбонат натрия. Он известен под названиями кальцинированная сода и кристаллическая сода
Кальцинированную соду применяют при производстве мыла, стекла, для получения неорганических красителей, в производстве алюминия и др.
Кислую соль — гидрокарбонат натрия называют питьевой содой. Питьевую соду применяют в быту и пищевой промышленности. Если добавить питьевую соду в тесто, то при выпечке изделий она разлагается с выделением углекислого газа. Это приводит к разрыхлению теста, и изделия из него становятся более пышными и пористыми.
Карбонат кальция, существующий в природе в виде мрамора и известняка, широко используют в строительстве в качестве облицовочных и архитектурно-строительных материалов. На рисунке 97 вы видите станцию Минского метрополитена «Грушевка», при строительстве которой использовалась отделка мрамором.
Слабая угольная кислота H2CO3 образуется при растворении углекислого газа в воде.
Угольная кислота образует два ряда солей: кислые — гидрокарбонаты и средние — карбонаты.
Карбонаты и гидрокарбонаты способны к взаимопревращениям.
Карбонаты как соли слабой кислоты взаимодействуют со всеми более сильными кислотами с выделением углекислого газа.
Соли угольной кислоты, кроме карбонатов большинства щелочных металлов, при нагревании разлагаются с выделением углекислого газа.
Понятие об органических веществах
Общее число известных на сегодняшний день веществ огромно — их насчитывается более 150 млн! Абсолютное большинство из них составляют органические вещества. Такое название они получили потому, что многие из них были выделены из организмов животных и растений.
Одними из первых таких веществ, вероятно, были жиры. Древний человек, занимавшийся охотой и собирательством, узнал о них в процессе приготовления пищи. Зажаривая на костре добытых на охоте животных или растирая семена некоторых растений, он наблюдал выделение вязких жидкостей, обладавших схожими свойствами. Эти вещества были очень питательными и давали организму много сил. Люди давно научились выделять жиры из природных объектов и уже много веков используют их как продукты питания или материалы для получения других полезных веществ. Сегодня каждому знакомы жиры животного происхождения — свиной жир, сливочное масло, а также жиры, добываемые из растений, — подсолнечное, оливковое, льняное, пальмовое, арахисовое и другие масла.
Готовя на костре мясо, древний человек случайно сделал важное открытие. Оказалось, что капли жира, попадая на влажную золу и остывая, постепенно превращались в плотную массу, которая пенилась в воде и хорошо смывала грязь с рук. Вероятно, именно так люди впервые познакомились с мылом, без которого невозможно представить нашу жизнь. Конечно, сегодня мыло получают другим способом, но его основой по-прежнему остаются жиры.
Еще одно важное наблюдение было сделано в древности. При отжимании измельченных стеблей одного из видов тростника из них выделялась жидкость приятного сладкого вкуса. При упаривании этой жидкости получалось твердое, еще более сладкое вещество, получившее название сахар. А из жидкости, отжатой из клубней картофеля, было выделено белое вещество, названное крахмалом. Впоследствии установили, что сахар и крахмал — представители большого класса веществ — углеводов.
Перемалывая зерна различных злаков, люди получили муку, при замешивании которой с водой образуется тесто для выпечки хлеба. В первой половине XVIII в. из теста впервые выделили клейковину — эластичную и упругую массу. Впоследствии оказалось, что она представляет собой смесь особых веществ — белков, которые бывают растительного (клейковина) и животного (белок куриного яйца) происхождения.
Подавляющее большинство органических соединений, известных в настоящее время, являются неприродными веществами — их получают искусственно в химических лабораториях или на химических предприятиях (рис. 98, 99). Они входят в состав различных ценных материалов — синтетических волокон и каучуков, пластмасс и лекарственных препаратов, моющих средств и красителей, ядохимикатов и удобрений, взрывчатых веществ. Каждую неделю, благодаря научным исследованиям, число органических веществ увеличивается примерно на 10 000.
Все органические вещества обладают рядом общих свойств, непохожих на свойства неорганических веществ. Чем же органические вещества отличаются от неорганических?
Во-первых, количеством, которое более чем в 149 раз превосходит число неорганических соединений. Органические вещества невероятно многообразны, и количество классов этих соединений в десятки раз больше, чем неорганических веществ. Многочисленность органических веществ и многообразие их классов обусловлены особенностями их состава и строения, с которыми вы познакомитесь в следующем параграфе.
Во-вторых, в состав молекул всех органических веществ обязательно входят атомы углерода, связанные с атомами небольшого числа элементов — чаще всего водорода, кислорода, азота, серы, галогенов, фосфора. Этим органические вещества резко отличаются от неорганических, в состав которых могут входить атомы всех известных химических элементов. Отметим, что такие простейшие соединения углерода, как его оксиды CO и , угольная кислота и ее соли традиционно относятся к неорганическим веществам.
В-третьих, многие органические соединения термически неустойчивы и даже при относительно невысоких температурах разлагаются с образованием углерода, т. е. обугливаются. При сгорании в кислороде они образуют углекислый газ и воду. Что касается неорганических веществ, то большинство из них термически устойчивы или разлагаются при очень высоких температурах. Продуктами их сгорания в кислороде являются самые разнообразные вещества.
В-четвертых, для органических веществ характерны ковалентная полярная и ковалентная неполярная связи. Этим органические вещества также отличаются от неорганических, которым, кроме указанных типов связи, присущи также ионная и металлическая связи.
В-пятых, почти все органические вещества являются соединениями молекулярного строения с невысокими температурами плавления. Для них характерны молекулярные кристаллические решетки. В то же время большинство неорганических веществ относятся к соединениям немолекулярного строения с высокими температурами плавления. Для них более характерны атомные или ионные кристаллические решетки.
Несмотря на существенные различия между органическими и неорганическими веществами, их разделение на две группы является условным. И те, и другие вещества образуются и превращаются в соответствии с одними и теми же законами природы. Органические и неорганические вещества объединяет их способность к взаимному превращению. Например, в результате фотосинтеза из неорганических веществ — углекислого газа и воды — образуется органическое вещество глюкоза. Являясь компонентом пищи, в организмах человека и животных она снова превращается в исходные неорганические соединения. Это взаимопревращение является основой круговорота углерода в природе.
Углерод — основа органических соединений
Вы не однажды наблюдали, как из выхлопной трубы неисправного автомобиля, работающего на дизельном топливе, вырываются клубы густого черного дыма (рис. 100). Он медленно поднимается вверх и смешивается с воздухом, загрязняя его. Откуда же берется этот дым? Почему он черный, хотя жидкое дизельное топливо, которым заправляется машина, прозрачное и почти
бесцветное? Дело вот в чем. В состав этого топлива входят различные соединения углерода с водородом, так называемые углеводороды, например При работе исправного двигателя они смешиваются с воздухом и полностью сгорают с выделением теплоты, образуя углекислый газ и воду, например:
Если же двигатель неисправен, то некоторая часть углеводородов сгорает не полностью: кислород из воздуха связывается лишь с атомами Н, а оставшиеся атомы углерода образуют простое вещество углерод, например:
Углерод в виде мельчайших частичек черного цвета с силой выбрасывается выхлопными газами из двигателя наружу, образуя облако черного дыма.
Образование углерода из органических веществ можно наблюдать и в школьной лаборатории. Проведем эксперимент. В пробирку насыплем немного белого порошка глюкозы и нагреем ее в пламени спиртовки. Сначала глюкоза расплавится и превратится в вязкую жидкость, которая при дальнейшем нагревании начнет пениться и темнеть. Через некоторое время на стенках пробирки образуются капельки воды, а на ее дне останется твердое вещество черного цвета — углерод (рис. 101).
Углерод образуется и при сильном нагревании других органических веществ и материалов на их основе. О чем же свидетельствуют выделение черного дыма из выхлопных труб автомобилей и почернение глюкозы при нагревании? Конечно, о том, что в состав молекул органических веществ
входят атомы углерода. Доказательством этого является и тот факт, что при полном сгорании органических веществ в кислороде наряду с другими веществами всегда образуется углекислый газ
Атомы углерода, связанные с атомами других элементов, присутствуют в молекулах всех без исключения органических веществ. По этой причине раздел химии, изучающий эти вещества, — органическую химию — называют химией соединений углерода.
Почему же из 118 химических элементов именно углерод является основой всех органических веществ? Ответ на этот вопрос кроется в особенностях строения атома данного элемента.
Поскольку углерод — химический элемент с атомным номером 6, расположенный во втором периоде периодической системы, в его атоме 6 электронов распределены на двух электронных слоях. Так как углерод является элементом IVA-группы, на внешнем электронном слое его атома находится 4 электрона:
Электронное строение атома обусловливает следующие его особенности.
1. Из-за наличия на внешнем электронном слое атома углерода 4 электронов он не обладает ярко выраженной способностью отдавать или принимать электроны и превращаться таким образом в ионы. Поэтому атомы углерода образуют не ионные, а только ковалентные связи, характерные для молекул органических веществ.
2. Из-за того, что радиус атома углерода невелик, образуемые им ковалентные связи являются очень прочными. Атомы углерода образуют такие ковалентные связи с атомами большинства известных химических элементов.
3. Так как на внешнем электронном слое атома углерода имеется 4 электрона, он проявляет валентность, равную IV, — образует с другими атомами четыре ковалентные связи. Это могут быть четыре одинарные связи; две одинарные и одна двойная; две двойные; одна одинарная и одна тройная связи:
Вот примеры молекул органических веществ с такими связями:
4. Атомы углерода, в отличие от атомов других элементов, способны соединяться в цепочки любой длины. Они могут быть неразветвленными, разветвленными и замкнутыми в циклы (рис. 102):
А это примеры молекул органических веществ с такими цепочками атомов углерода (рис. 103):
Таким образом, атомы только одного химического элемента — углерода — могут соединяться как с атомами других элементов, так и между собой, образуя цепочки или циклы, в которых атомы углерода связаны с другими атомами одинарными, двойными или тройными связями. Такая уникальность атомов углерода является основой невероятно большого количества органических соединений и многообразия их классов.
- Атомы углерода образуют ковалентные связи, характерные для молекул органических веществ.
- Атомы углерода образуют химические связи с атомами большинства известных элементов.
- Атомы углерода соединяются с другими атомами четырьмя ковалентными связями (одинарными или кратными).
- Атомы углерода способны соединяться между собой в цепочки любой длины, которые могут быть неразветвленными, разветвленными и замкнутыми в циклы.
Значение органических веществ в природе и жизни человека
Мир органических веществ огромен и разнообразен. В настоящее время по своему происхождению они делятся на две группы. К первой группе относятся органические соединения природного происхождения, входящие в состав всех живых организмов — человека, животных, растений и др. Они встречаются и в неживой природе в виде нефти и природного газа. Вторую группу составляют органические вещества неприродного (искусственного) происхождения. Познакомимся с ролью органических веществ в природе и жизни человека.
Органические вещества природного происхождения
Во всех процессах, протекающих в живых организмах, участвуют органические вещества природного происхождения. Важнейшими из них являются белки, жиры, углеводы, витамины, различные кислоты, ферменты и гормоны.
Белки — жизненно важные вещества, молекулы которых представляют собой цепочки из многих тысяч атомов углерода, водорода, кислорода, азота и серы. Кроме знакомого нам с детства белка куриного яйца, известно несколько миллионов других белков. Они содержатся в телах всех живых организмов и выполняют множество функций. Например, белки входят в состав мышц, костей, крови, образуют хрящи, кожу, волосы, ногти, рога, копыта, перья, чешую (рис. 104). Белки участвуют в процессах сокращения мышц, защищают организм от инфекций. В живых организмах некоторые белки играют роль ферментов и гормонов, которые регулируют все жизненно важные процессы.
В организмах растений белки в наибольшем количестве содержатся в семенах, где они откладываются в запас. Особенно богаты белком семена гороха, фасоли, сои, зерна пшеницы.
Белки являются важным источником энергии для человека и животных, они входят в состав продуктов питания.
Некоторые природные яды имеют белковую природу и оказывают на человека отравляющее действие. Это белки яда змей, некоторых пауков, пчел, ос, а также белки ядовитых грибов, например бледных поганок и мухоморов.
Наряду с белками важнейшие жизненные функции выполняют нуклеиновые кислоты. Их молекулы, состоящие из огромного числа атомов углерода, водорода, кислорода, азота и фосфора, являются «шаблонами», по которым организмы синтезируют нужные белки. Нуклеиновые кислоты — это своего рода запоминающие устройства, с помощью которых каждый вид живых организмов передает из поколения в поколение «прописи» строения своих белков.
Жиры — сложные органические вещества, в состав которых входят атомы углерода, водорода и кислорода. Они содержатся в организмах человека, животных, растений и др. Всем известны жиры животного происхождения, например свиной, говяжий, бараний жир, сливочное масло (рис. 105). Жиры растительного происхождения называются маслами. К ним относятся подсолнечное, льняное, рапсовое, оливковое, арахисовое, пальмовое и другие масла. Они накапливаются в семенах или в плодах растений. Проверить это можно, положив на лист бумаги семя подсолнечника и сильно нажав на него. На бумаге появится маслянистое пятно.
Жиры являются самым важным источником энергии для человека и составной частью пищи. Образуя жировые капсулы, жиры предохраняют внутренние органы от сотрясений и защищают организм от переохлаждения. Жиры, выделяемые кожными сальными железами, делают кожу человека мягкой и эластичной, а волосы — блестящими. Вместе с белками жиры являются запасным строительным материалом, из которого образуются новые клетки организма.
Углеводы — сложные органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода. Углеводы образуются в зеленых растениях в процессе фотосинтеза из углекислого газа и воды. Они входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органических веществ на Земле.
Зеленые растения в процессе фотосинтеза ежегодно поглощают из атмосферы приблизительно 200 млрд т углекислого газа CO3. При этом в атмосферу поступает около 130 млрд т кислорода O2 и синтезируется 50 млрд т углеводов.
Животные организмы не способны синтезировать углеводы, поэтому получают их из растительных источников. К углеводам относятся, например, глюкоза, фруктоза, сахароза, крахмал, целлюлоза и др. Глюкоза, фруктоза и сахароза содержатся в соке овощей и фруктов, придавая им сладкий вкус. Глюкоза — обязательный компонент организма человека. Сахарозой богаты сахарная свекла и сахарный тростник — основные источники сахара. Крахмал накапливается в клубнях, плодах, семенах растений. Так, в клубнях картофеля содержится до 24 % крахмала, в зернах пшеницы — до 64 %, риса — 75 %, кукурузы — 70 %. Глюкоза, фруктоза, сахароза и крахмал являются важными источниками энергии для человека. Они легко усваиваются и входят в состав продуктов питания. Целлюлоза (клетчатка) — углевод, из которого состоят стенки клеток всех высших растений. Целлюлоза знакома каждому человеку и встречается буквально на каждом шагу. Пух тополя и парашютики одуванчика, вата, изготовленная из семян хлопчатника (рис. 106), лен, солома, бумага — все это почти чистая целлюлоза. Она входит в состав такого важного материала, как древесина. В организмах млекопитающих, к которым относится и человек, целлюлоза не усваивается. Однако она является основным кормом многих травоядных животных, например коров, овец, лошадей, оленей.
Витамины — это органические вещества, которые не поставляют организму энергию, но необходимы ему в небольших количествах для поддержания жизни. Естественным источником витаминов являются витаминоносные растения (шиповник, цитрусовые, петрушка, лук, капуста, морковь, смородина, рябина, облепиха и др.), а также некоторые продукты питания животного происхождения. Многие витамины сегодня получают синтетическим путем.
Витамины поступают в организм с пищей и участвуют практически во всех процессах, протекающих в нашем организме. Они необходимы для нормальной работы желез внутренней секреции, повышения умственной и физической работоспособности, устойчивости организма к воздействию неблагоприятных факторов внешней среды (жара, холод, инфекции, отравления). В настоящее время известно около 20 различных витаминов. Это, например, витамин С — знакомая вам «аскорбинка», а также витамины и др. Нехватка витаминов, так же как и их избыток в организме, являются причиной различных заболеваний.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
Графит
Чаще всего в природе чистый углерод можно встретить в форме графита — мягкого черного материала, легко расслаивающегося и словно скользкого на ощупь. Многие могут вспомнить, что из графита делаются грифели карандашей — но это не всегда верно. Часто грифель делают из композита графитовой крошки и клея, но встречаются и полностью графитовые карандаши. Интересно, но на карандаши уходит больше одной двадцатой всей мировой добычи естественного графита.
Чем необычен графит? В первую очередь, он хорошо проводит электрический ток — хотя сам углерод и не похож на другие металлы. Если взять пластинку графита, то окажется, что вдоль ее плоскости проводимость примерно в сто раз больше, чем в поперечном направлении. Это напрямую связано с тем, как организованы атомы углерода в материале.
Если посмотреть на структуру графита, то мы увидим, что она состоит из отдельных слоев толщиной в один атом. Каждый из слоев — сетка из шестиугольников, напоминающая собой соты. Атомы углерода внутри слоя связаны ковалентными химическими связями. Более того, часть электронов, обеспечивающих химическую связь, «размазана» по всей плоскости. Легкость их перемещения и определяет высокую проводимость графита вдоль плоскости углеродных чешуек.
Отдельные слои соединяются между собой благодаря ван-дер-ваальсовым силам — они гораздо слабее, чем обычная химическая связь, но достаточны для того, чтобы кристалл графита не расслаивался самопроизвольно. Такое несоответствие приводит к тому, что электронам гораздо сложнее перемещаться перпендикулярно плоскостям — электрическое сопротивление возрастает в 100 раз.
Благодаря своей электропроводности, а также возможности встраивать атомы других элементов между слоями, графит применяется в качестве анодов литий-ионных аккумуляторов и других источников тока. Электроды из графита необходимы для производства металлического алюминия — и даже в троллейбусах используются графитовые скользящие контакты токосъемников.
Кроме того, графит — диамагнетик, причем обладающий одной из самых высоких восприимчивостей на единицу массы. Это означает, что если поместить кусочек графита в магнитное поле, то он всячески будет пытаться вытолкнуть это поле из себя — вплоть до того, что графит может левитировать над достаточно сильным магнитом.
И последнее важное свойство графита — невероятная тугоплавкость. Самым тугоплавким веществом на сегодняшний день считается один из карбидов гафния с температурой плавления около 4000 градусов Цельсия. Однако если попытаться расплавить графит, то при давлениях около ста атмосфер он сохранит твердость вплоть до 4800 градусов Цельсия (при атмосферном давлении графит сублимирует — испаряется, минуя жидкую фазу). Благодаря этому материалы на основе графита используют, например, в корпусах ракетных сопел.
Физические свойства
Своими физическими свойствами углерод типичный неметалл. При этом он образует множество аллотропных модификаций («аллотропные» означает существование двух и более разных веществ из одного химического элемента): наиболее популярными из них являются алмаз, графит, уголь, сажа. При этом алмаз – одно из самых твердых веществ, представляющих углерод.
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Графен
Вместо того чтобы сжимать и нагревать графит, мы, следуя за Андреем Геймом и Константином Новоселовым, приклеим к кристаллу графита кусочек скотча. Затем отклеим его — на скотче останется тонкий слой графита. Повторим эту операцию еще раз — приложим скотч к тонкому слою и снова отклеим. Слой станет еще тоньше. Повторив процедуру еще несколько раз, мы получим графен — материал, за который вышеупомянутые британские физики получили Нобелевскую премию в 2010 году.
Графен представляет собой плоский монослой из атомов углерода, полностью идентичный атомарным слоям графита. Его популярность связана с необычным поведением электронов в нем. Они двигаются так, словно бы вовсе не обладают массой. В действительности, конечно, масса электронов остается все той же, что и в любом веществе. Во всем «виноваты» атомы углерода графенового каркаса, притягивающие заряженные частицы и образующие особенное периодическое поле.
Устройство на основе графена. На заднем плане фотографии — золотые контакты, над ними находится графен, выше — тонкий слой полиметилметакрилата
Engineering at Cambridge / flickr.com
Поделиться
Следствием такого поведения стала большая подвижность электронов — они перемещаются в графене гораздо быстрее, чем в кремнии. По этой причине многие ученые надеются, что основой электроники будущего станет именно графен.
Интересно, что у графена есть углеродные собратья — пентаграфен и фаграфен. Первый из них состоит из немного искаженных пятиугольных секций и, в отличие от графена, плохо проводит электрический ток. Фаграфен состоит из пяти-, шести- и семиугольных секций. Если свойства графена одинаковы во всех направлениях, то фаграфен будет обладать выраженной анизотропией свойств. Оба этих материала были предсказаны теоретически, но в реальности пока не существуют.
Обломок кремниевого монокристалла (на переднем плане) на вертикальном массиве углеродных нанотрубок
zeiss.com
Химические свойства
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание: 2C0 + O2 –t°= 2C+2O угарный газ
— со фтором С + 2F2 = CF4
— с водяным паром C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды. C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями: C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод: С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
Вступая в реакцию с водородом, углерод образует метан:
C0 + 2H2 = CH4
Фуллерены
Хотя шестиугольник — одна из самых стабильных конфигураций, которые могут образовывать атомы углерода, есть целый класс компактных объектов, где встречается правильный пятиугольник из углерода. Эти объекты называются фуллеренами.
В 1985 году Гарольд Крото, Роберт Кёрл и Ричард Смолли исследовали пары углерода и то, в какие фрагменты слипаются атомы углерода при охлаждении. Оказалось, что в газовой фазе есть два класса объектов. Первый — кластеры, состоящие из 2–25 атомов: цепочки, кольца и другие простые структуры. Второй — кластеры, состоящие из 40–150 атомов, не наблюдавшиеся ранее. За следующие пять лет химикам удалось доказать, что этот второй класс представляет собой полые каркасы из атомов углерода, наиболее устойчивый из которых состоит из 60 атомов и повторяет по форме футбольный мяч. C60, или бакминстерфуллерен, состоял из двадцати шестиугольных секций и 12 пятиугольных, скрепленных между собой в сферу.
Открытие фуллеренов вызвало большой интерес химиков. Впоследствии был синтезирован необычный класс эндофуллеренов — фуллеренов, в полости которых находился какой-либо посторонний атом или небольшая молекула. К примеру, всего лишь год назад в фуллерен впервые поместили молекулу плавиковой кислоты, что позволило очень точно определить ее электронные свойства.
Фуллериты — кристаллы фуллеренов
Wikimedia Commons
Поделиться
В 1991 году оказалось, что фуллериды — кристаллы фуллеренов, в которых часть полостей между соседними многогранниками занимают металлы, — это молекулярные сверхпроводники с рекордно высокой температурой перехода для этого класса, а именно 18 кельвин (для K3C60). Позднее нашлись фуллериды и с еще большей температурой перехода — 33 кельвина, Cs2RbC60. Такие свойства оказались напрямую связаны с электронной структурой вещества.
Роль в природе
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
Применение
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.
Карбин
Говоря о вытянутых структурах из атомов углерода, нельзя не упомянуть карбины. Это линейные цепочки, которые по оценкам теоретиков могут оказаться самым прочным материалом из возможных (речь идет об удельной прочности). К примеру, модуль Юнга для карбина оценивается в 10 гиганьютон на килограмм. У стали этот показатель в 400 раз меньше, у графена — по меньшей мере в два раза меньше.
Тонкая нить, тянущаяся к железной частице внизу — карбин
Wikimedia Commons
Поделиться
Карбины бывают двух типов, в зависимости от того, как устроены связи между атомами углерода. Если все связи в цепочке одинаковые, то речь идет о кумуленах, если же связи чередуются (одинарная-тройная-одинарная-тройная и так далее), то о полиинах. Физики показали, что нить карбина можно «переключать» между этими двумя видами путем деформации — при растяжении кумулен превращается в полиин. Интересно, что это радикально меняет электрические свойства карбина. Если полиин проводит электрический ток, то кумулен— диэлектрик.
Главная сложность в изучении карбинов — их очень сложно синтезировать. Это химически активные вещества, к тому же легко окисляющиеся. На сегодняшний день получены цепочки длиной лишь в шесть тысяч атомов. Чтобы достигнуть этого, химикам пришлось растить карбин внутри углеродной нанотрубки. Кроме того, синтез карбина поможет побить рекорд размера затвора в транзисторе — его удастся уменьшить до одного атома.
Рекомендованная литература и полезные ссылки
- Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ChemNet. Углерод: история открытия элемента.
- Лейпунский О. И. Об искусственных алмазах (рус.) // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.
Видео
И в завершение образовательное видео по теме нашей статьи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора