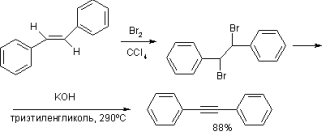
Свойства и получение ацетилена
В условиях атмосферного давления и нормальной температуры ацетилен представляет собой бесцветный газ. Если температура опускается до значения -85 градусов и ниже, то это соединение переходит в другое состояние – твердое. При этом образуются кристаллы. Следует отметить, что в жидком и твердом состоянии ацетилен может легко взрываться под воздействием трения или при ударе (гидравлическом или механическом). Именно это свойство во многом обусловливает его область применения. Реакции горения ацетилена происходят в присутствии кислорода. В результате данного процесса возникает пламя, характеризующееся самыми высокими показателями температуры (3150 градусов) по сравнению с другими видами горючего.
Основным способом получения ацетилена является реакция, в которой взаимодействуют карбид кальция и вода. Данный процесс протекает при показателях температуры около 2000 градусов и является эндотермическим.
Существует такое понятие, как выход ацетилена. Это такое его количество, которое выделяется в результате разложения 1 кг карбида кальция. ГОСТ 1460-56 устанавливает конкретные значения данной величины, которая находится в прямой зависимости от степени грануляции исходного вещества. Таким образом, следствием относительно небольшого размера частиц карбида кальция является снижение выхода ацетилена.
Данная закономерность является следствием наличия в мелких частицах карбида посторонних примесей, например оксида кальция.
Существуют и другие, менее громоздкие, дорогие и энергозатратные способы получения ацетилена. Например, реакция термоокислительного пиролиза метана из природного газа; разложение нефти, керосина и других видов горючего путем электропиролиза.
АЦЕТИЛЕН
АЦЕТИЛЕН (этин) – углеводород состава С2Н2, содержащий тройную углерод-углеродную связь. Название этого соединения уже более ста лет знакомо не только химикам. С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (СаС2 + 2Н2О ® С2Н2 + Са(ОН)2), этот газ стали использовать для освещения. В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени – от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Также по теме:
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О ® С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Он был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом. На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н ® С2Н2. (Сейчас ацетилом называют группировку СН3СО; она входит в состав солей уксусной кислоты – ацетатов, а также ацетона СН3СО–СН3, ацетальдегида СН3СО–Н, ацетилхлорида СН3СО–Cl и многих других соединений.)
Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами, а в 1867 сделал очень важное для химической теории открытие: показал, что из трех молекул ацетилена можно получить молекулу бензола: 3С2Н2 ® С6Н6.
Также по теме:
УГЛЕРОД
Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С ® СаС2 + СО. В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина AsH3. Сейчас широко применяются методы получения ацетилена из природного газа – метана: электрокрекинг 2СН4 ® С2Н2 + 3Н2 (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена); термоокислительный крекинг (неполное окисление) 6СН4 + 4О2 ® С2Н2 + 8Н2 + 3СО + СО2 + 3Н2О (в реакции используют теплоту частичного сгорания ацетилена).
Чистый ацетилен при охлаждении сжижается при –83,8° С, а при дальнейшем понижении температуры быстро затвердевает. Он умеренно растворим в воде (1150 мл в 1 л воды при 15° С и атмосферном давлении) и хорошо в органических растворителях, особенно в ацетоне (25 л в 1 л ацетона при тех же условиях и 300 л под давлением 12 атм). Термодинамически ацетилен неустойчив; он взрывается при нагревании до 500° С, а при обычной температуре – при повышении давления до 2 атм. Поэтому его хранят в баллонах, наполненных пористым инертным материалом, который пропитан ацетоном.
Также по теме:
ВЗРЫВЧАТЫЕ ВЕЩЕСТВА
Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с газами – с кислородом (он окрашен в голубой цвет) и с ацетиленом (белого цвета). Газы из баллонов поступают в специальную горелку. Еще в 1895 году было обнаружено, что при сгорании ацетилена в кислороде получается очень горячее пламя; максимальная его температура (3150° С) достигается при содержании ацетилена 45% по объему. В таком пламени очень быстро расплавляются даже толстые куски стали.
Химия ацетилена впервые была детально изучена в работах академика А.Е.Фаворского (1860–1945). Оказалось, что ацетилен может служить исходным продуктом для синтеза многих более сложных органических соединений. Эта область применения ацетилена в настоящее время является самой обширной. Ацетилен – реакционноспособное соединение, вступающее в многочисленные реакции. В 1881 М.Г.Кучеров открыл реакцию присоединения к ацетилену воды в присутствии катализатора – солей ртути, при этом образуется ацетальдегид: С2Н2 + Н2О ® СН3СНО. Из ацетальдегида далее получают уксусную кислоту, ацетон, спирт.
В 1949 немецкий химик В.Ю.Реппе открыл важную реакцию карбонилирования (присоединения СО) ацетилена в присутствии никелевого катализатора: С2Н2 + СО + Н2О ® СН2=СН–СООН. Образующаяся в этой реакции непредельная акриловая кислота используется для получения разнообразных полимеров – акрилатов (к ним относится и органическое стекло – полиметилметакрилат). А присоединение к ацетилену синильной кислоты дает другой важнейший продукт – нитрил акриловой кислоты (акрилонитрил): C2H2 + HCN ® CH2=CH–CN. Его полимеризацией получают очень важные полиакрилонитрильные полимеры, из которых делают искусственные волокна, пластики, каучуки.
Галогены и гидрогалогены (последние – в присутствии катализаторов) легко присоединяются к ацетилену с образованием сначала замещенных этилена, затем – этана, например: HCєCH + Cl2 ® ClCH=CHCl, ClCH=CHCl + Cl2 ® CHCl2–CHCl2; HCєCH + HCl ® CH2=CHCl, CH2=CHCl + HCl ® CH3–CHCl2 (последние две реакции идут по правилу Марковникова). Образующиеся хлорпроизводные широко используются в качестве полупродуктов для дальнейших синтезов, а также как растворители (например, в химчистке).
Ацетилен является слабой кислотой, в присутствии сильных оснований возможна ионизация этой связи с образованием ацетиленид-иона НєС–С–. Возможна ионизация и второй связи С–Н, поэтому при пропускании ацетилена в аммиачные растворы солей серебра и меди(I) образуются белый ацетиленид серебра C2Ag2 и красно-бурый ацетиленид меди C2Cu2. Оба соединения нерастворимы и выпадают в осадок; в сухом виде они они являются взрывчатыми веществами. Карбид кальция СаС2 также можно рассматривать как ацетиленид. Эти солеобразные соединения имеют ионную кристаллическую решетку, в узлах которой находятся катионы металла и анионы С22–.
В кислой среде в присутствии ионов Cu+ ацетилен димеризуется с образованием винилацетилена НСєС–СН=СН2.
При его полимеризации образуются продукты, которые используются в производстве лакокрасочных материаловю – винил- и дидивинилацетиленовых лаков.
Приведенные примеры далеко не исчерпывают богатую химию ацетилена, из которого можно получить сотни разнообразных соединений. Недаром его годовое производство превышает 5 млн тонн. Из них примерно 70% используют для промышленного органического синтеза, а 30% – для сварки и резки металлов.
Илья Леенсон
Хранение и транспортировка
Все способы хранения и транспортировки предусматривают использование баллонов. Они заполняются специальной массой пористой консистенции. Ее пропитывают ацетоном, который хорошо растворяет ацетилен. Применение данного способа позволяет значительно увеличить наполняемость баллона ацетилена и, что немаловажно, понижает его взрывоопасность.
Длительное соприкосновение ацетилена с такими металлами, как медь и серебро, может привести к повышению его взрывоопасности. Следовательно, недопустимо использование материалов, которые могут содержать эти металлы, например в вентилях.
Как правило, баллоны должны иметь специальные вентили, предназначенные именно для хранения ацетилена.
Полного использования всей емкости баллона можно достигнуть, храня пустые емкости так, чтобы ацетон был распределен по всему объему баллона. А это возможно только в горизонтальном положении. Наполнение баллона должно происходить очень медленно, что важно для соблюдения условий химической реакции растворения ацетилена в ацетоне, а в частности ее скорости.
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм 3 /час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
Читать также: Тигель из шамотной глины
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм 3 /час, при правом 650-750 дм 3 /час.
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Преимущества растворенного ацетилена
Основное преимущество растворенного ацетилена перед тем, который получают с использованием переносных генераторов из карбида кальция, состоит в том, что при применении баллонов происходит повышение труда сварщика примерно на 20 %, а потери ацетилена при этом снижаются на 25 %. Также следует отметить повышение оперативности и маневренности сварочного поста, безопасность. В отличие от газа, полученного из карбида кальция, растворенный ацетилен содержит значительно меньше посторонних веществ, то есть примесей, что позволяет использовать его в особо ответственных сварочных работах.
Молекулярная формула ацетилена
Этин — простейший член своего гомологического ряда, его состав и строение отражают формулы:
- С2Н2 — молекулярная запись состава этина, которая дает представление о том, что вещество образовано двумя углеродными атомами и таким же числом атомов водорода. По этой формуле можно рассчитать молекулярную и молярную массы соединения. Mr (С2Н2) = 26 а. е. м., М (С2Н2) = 26,04 г/моль.
- Н:С:::С:Н — электронно-точечная формула ацетилена. Подобные изображения, получившие название «структуры Льюиса», отражают электронное строение молекулы. При написании необходимо соблюдать правила: атом водорода стремится при образовании химической связи обладать конфигурацией валентной оболочки гелия, другие элементы — октетом внешних электронов. Каждое двоеточие означает общую для двух атомов или неподеленную пару электронов внешнего энергетического уровня.
- H—C≡C—H — структурная формула ацетилена, отражающая порядок и кратность связей между атомами. Одна черточка заменяет собой одну пару электронов.
Ацетилен: применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.
Баллоны с этим газом маркируют следующим образом: окрашивают в белый цвет и большими красными буквами наносят надпись: «Ацетилен»
Строительные работы проводятся в основном на открытом воздухе. Применение ацетилена и его гомологов в этих условиях не должно проходить под воздействием прямых солнечных лучей. Небольшие перерывы должны сопровождаться перекрыванием вентилей на горелке, а длительные – перекрыванием вентилей на самих баллонах.
Читать также: Приставка к болгарке цепная пила
В химической промышленности очень востребован ацетилен. Применение его заключается в использовании данного вещества в процессе получения продуктов органического синтеза. Это синтетический каучук, пластмассы, растворители, уксусная кислота и т.д.
Ацетилен, являясь универсальным горючим, часто используется в процессах, сопровождающихся газопламенной обработкой. Важно, что применение ацетилена в промышленности возможно только при соблюдении мер безопасности, так как он является взрывоопасным газом.
Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
Карбидные лампы
Название «карбидная лампа» обусловлено использованием в качестве источника света открытого пламени струи сжигаемого ацетилена. Он, соответственно, получен в результате взаимодействия карбида кальция с водой.
Такие лампы были широко распространены в прошлом. Их можно было увидеть на каретах, автомобилях и даже велосипедах. В современное время карбидные лампы используют только в случае острой необходимости в мощном автономном светильнике. Так, спелеологи часто пользуются ими. Отдаленные маяки снабжают именно такими лампами, ведь такой тип освещения намного выгоднее, нежели подведение линий электропередач. Достаточно распространенным является использование таких ламп на судах дальнего плавания.
Номенклатура
Алкинами, ацетиленовыми углеводородами называют углеводороды, в состав молекул которых входят как минимум два углеродных атома, находящиеся в состоянии sp-гибридизации и соединенные друг с другом тремя связями.
Алкины образуют гомологический ряд с общей формулой СnН2n-2.
Первым членом гомологического ряда является ацетилен имеющий молекулярную формулу С2Н2 и структурную формулу СНСН. В силу особенности sp-гибридизации молекула ацетилен имеет линейное строение. Наличие двух π-связей расположенных в двух взаимно перпендикулярных плоскостях предполагает расположение α-атомов замещающих групп на линии пересечения плоскостей, в которых расположены π-связи. Поэтому связи атомов углерода, затраченные на соединение с другими атомами или группами жестко расположены на линии под углом 1800 друг к другу. Строение системы тройной связи в молекулах алкинов определят их линейное строение.
Особенность строения молекул алкинов предполагает существование изомерии положения тройной связи. Структурная изомерия, обусловленная строением углеродного скелета, начинается с пятого члена гомологического ряда.
1. Изомерия положения тройной связи. Например:
2. Структурные изомеры. Например:
Первый член гомологического ряда носит тривиальное название «ацетилен».
По рациональной номенклатуре ацетиленовые углеводороды рассматриваются как производные ацетилена, Например:
По номенклатуре ИЮПАК названия алкинов образуются заменой суффикса «ан» на «ин». Главную цепь выбирают таким образом, чтобы в нее попала тройная связь. Нумерацию углеродных атомов начинают с того конца цепи, к которому ближе тройная связь. При наличии в молекуле двойной и тройной связей двойная связь имеет меньший номер. Например:
Тройная связь может быть концевой (терминальной, например, в пропине) или «внутренней», например в 4-метил-2-пентине.
При составлении названий радикал -ССН называют «этинил».
Ацетилен: применение в медицине
Как используется вещество в этой сфере? Общая анестезия предполагает применение алкинов. Ацетилен является одним из тех газов, которые используются при ингаляционном наркозе. Но повсеместное его применение в этом качестве осталось в прошлом. Сейчас появились более современные и безопасные способы анестезии.
Хотя следует отметить, что и применение ацетилена не представляло большой опасности, так как прежде чем значение его концентрации во вдыхаемом воздухе дойдет до опасного предела, нижний порог горючести будет пройден.
Самым главным условием использования данного газа является соблюдение мер безопасности. Сложно переоценить, насколько опасен ацетилен. Применение его возможно только после проведения всех необходимых инструктажей с работниками различных сфер, в которых он используется.
Ацетилен в условиях нормальной влажности воздуха и температуры является бесцветным газом, который получают в стационарных генераторах методом действия воды на карбид кальция. При понижении температуры до -85 градусов по Цельсию вещество переходит в твердое состояние, одновременно с этим образуются кристаллы. Важным свойством ацетилена является то, что при ударах или под воздействием трения он взрывается. Этот параметр во многом определяет область использования.
Характеристики
Разложение ацетилена является экзотермической реакцией . Его теплотворная способность составляет 24 000 ккал / . Точно так же его синтез обычно требует высоких температур на некоторых этапах или вклада химической энергии каким-либо другим образом.
Ацетилен является взрывоопасным газом, если его содержание в воздухе составляет от 2 до 82%. Он также взрывается при сжатии сам по себе, не растворяясь в другом веществе, поэтому для хранения его растворяют в ацетоне , жидком растворителе, который его стабилизирует.
Сварочные работы с использованием ацетилена
Традиционно этот газ применяют при проведении процедуры по автогенной сварке, а также резке металлов. Технология подразумевает использованием двух баллонов с газом, в одном из которых находится кислород, а в другом — ацетилен. Вещества поступают в специализированную горелку, и при сгорании образуется очень горячее пламя. Его температура может достигать 3200 градусов по Цельсию. Самым «эффективным» считается сочетание газов, при котором в смеси содержится 45% ацетилена. При таких условиях удается оперативно расплавить даже достаточно толстые куски листовой стали.
Преимущества ацетилена при газопламенной обработке металлов
Применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и тд.). Однако, преимущество ацетилена – в самой высокой температуре горения, которая достигает 3200 ° С. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
Читать также: Что такое запасовка каната
Сравнительные характеристики пламени при сварке различным газами
| Газ | Температура пламени, °C |
| Ацетилен | 3000 – 3200 |
| МАФ | 2930 |
| Пропан | 2600-2750 |
| Водород | 2100-2500 |
| Метан | 2000-2200 |
Использование в промышленности и быту
Впрочем, автогенная сварка и резка металлов — не единственная сфера применения. Достаточно часто ацетилен используют в качестве источника яркого белого света в автономных приборах освещения. В данном случае его получают с помощью реакции воды и карбида кальция.
Такие лампы были крайне востребованы в прошлом столетии, ими освещали кареты и автомобили. Но и сегодня карбидные устройства, то есть созданные с использованием ацетилена, применяют при благоустройстве отдаленных маяков. Ключевое преимущество карбидных ламп — экономичность и отсутствие необходимости в подключении к электросети. Соответственно, при их установке на маяке не возникает необходимости в подведении линии электропередач, то есть оплате дорогостоящей услуги. Также лампы востребованы на судах дальнего плавания.
Ацетилен используют в промышленности. Его применяют при получении различных продуктов органического синтеза. Например, его используют для создания:
- уксусной кислоты;
- синтетического каучука;
- растворителей;
- некоторых видов пластмасс.
Следует отметить, что ацетилен нашел применение и в медицине, например, его иногда используют при ингаляционном наркозе.
Общие сведения
Ацетилен — ненасыщенный углеводород C 2 H 2 . Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. В природе на Земле практически не встречается, т.к. из-за присутствия кислорода это крайне неустойчивое соединение, получается путем синтеза. Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Читать также: На какой высоте от пола вешать бра
Впервые газообразный ацетилен получил в 1836 г. Эдмунд Дэви при разложении водой карбида калия, полученного при сплавлении металлического калия с углем: К 2 С 2 + 2Н 2 О = С 2 Н 2 + 2КОН.
С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (CaC 2 + 2H 2 O = C 2 H 2 + Ca(OH) 2 , который в свою очередь получали прокаливанием смеси угля и негашеной извести (СаО + 3С = СаС 2 + СО), этот газ стали использовать для освещения. В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Содержание
- 1 Получение
- 1.1 В лаборатории
- 1.2 В промышленности
- 1.2.1 Получение пиролизом
- 1.2.1.1 Электрокрекинг
- 1.2.1.2 Регенеративный пиролиз
- 1.2.1.3 Окислительный пиролиз
- 1.2.1.4 Гомогенный пиролиз
- 1.2.1.5 Пиролиз в струе низкотемпературной плазмы
- 1.2.2 Карбидный метод
- 2 Физические свойства
- 3 Химические свойства
- 4 История
- 5 Применение
- 6 Безопасность
- 7 Примечания
- 8 Литература
- 9 Ссылки
Читать также: Можно ли подключить дифавтомат снизу
Получение
В лаборатории
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
В промышленности
В промышленности ацетилен получают из карбида кальция и пиролизом углеводородного сырья – метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом. Карбидный метод позволяет получать чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз менее энергозатратен, но образующийся ацетилен имеет низкую концентрацию в газовом потоке и требует выделения. Экономические оценки обоих методов многочисленны, но противоречивы .
Получение пиролизом
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000-3000°С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600°С. Расход электроэнергии составляет около 13000 кВт*ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50%.
Иное название – Вульф-процесс. Сначала разогревают насадку печи путем сжигания метана при 1350-1400°С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным как считалось на стадии проектирования.
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600°С. Выход ацетилена составляет 30-32%. Метод имеет преимущества – непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000°С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600°С. Образуется ацетилен. Метод характеризуется большей безопасностью и надежностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрен в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000-7000 кВт*ч) и высоких выходах ацетилена (87% в аргоновой плазме и 73% в водородной).
Карбидный метод
Этот способ известен с 19 века, но не потерял своего значения и до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500-3000°С:
Известь получают из карбоната кальция:
Далее карбид кальция обрабатывают водой:
Получаемый ацетилен имеет высокую степень чистоты 99,9%. Основным недостатком процесса является высокий расход электроэнергии: 10000-11000 кВт*ч на 1 тонну ацетилена.
использованная литература
- CAS-номер
- Справочник по газу Matheson. «Нижний и верхний пределы взрываемости для горючих газов и паров (НПВ/НПВ)» (PDF) (на английском языке) . Мэтисон Газ Продактс. п. 443 . Consultado эль 2 октября 2016 года .
- Генри Энфилд Роско и Карл Шорлеммер. A Treatise on Chemistry, D. Appleton and Co., 1833, стр. 614, в котором дается ссылка на отчеты Британской ассоциации,
1836 г., стр. 62. - «Из-за яркости, с которой новый газ горит при контакте с атмосферой, он, по мнению автора, превосходно приспособлен для искусственного освещения, если его можно достать по низкой цене». Уильям Джозеф Дибдин. «Ацетилен», Общественное освещение с помощью газа и электричества,
гл. XXIX, стр. 489. - Американский совет научных обществ. Словарь научной биографии,
сыновья Чарльза Скрибнера, Нью-Йорк, 1981, Vol. 2, с.67. - Популярный иллюстрированный энциклопедический словарь Сальват (1906 — 1914)
Список используемой литературы
- Национальный институт безопасности и гигиены труда Испании : Международный паспорт химической безопасности ацетилена.
| авторитетный контроль |
|
- Datos: Q133145
- Multimedia: Acetylene
Физические свойства
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии до 1,4 атм при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном.
Ацетилен обнаружен на Уране и Нептуне.
Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
… –CH=CH–CH=CH–CH=CH–…
Химические свойства
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/Кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Читать также: Как разобрать якорь электродвигателя
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
Модели молекулы ацетилена
Формулы, показывающие распределение электронов, послужили фундаментом для создания атомно-орбитальных моделей, пространственных формул молекул (стереохимических). Еще в конце XVIII века получили распространение шаростержневые модели — например, шарики разного цвета и размера, обозначающие углерод и водород, которые образуют ацетилен. Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
Шаростержневая модель ацетилена воспроизводит валентные углы, равные 180°, но межъядерные расстояния в молекуле отражаются приблизительно. Пустоты между шариками не создают представления о заполнении пространства атомов электронной плотностью. Недостаток устранен в моделях Дрейдинга, обозначающих ядра атомов не шариками, а точками присоединения стержней друг к другу. Современные объемные модели дают более яркое представление об атомных и молекулярных орбиталях.
Применение
Безопасность
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Баллоны с ацетиленом
Структурная и молекулярная формула: ацетилен
Баллоны с газами, в т.ч. ацетиленом. Нажмите для увеличения.
Ацетилен можно сжижать и отверждать, однако как в газообразном состоянии при давлении свыше примерно 7 бар, так и в жидком, и в твердом состоянии ацетилен чувствителен к ударному воздействию и взрывоопасен. Поэтому, ацетилен всегда поставляется пользователям в баллонах, растворенным в ацетоне или диметилформамиде и полностью заполненных пористым напонителем Agamassan (или AGA-massan, что расшифровывается в переводе со шведского как «состав AGA». AGA — это название шведской компании-производителя и поставщика промышленных газов, ныне подразделения компании Linde Gas, основанной в свое время изобретателем Agamassan’а Густафом Даленом. В состав Agamassan’а входя асбест, цемент, уголь и кизельгур). Как альтернатива Agamassan’у, может использоваться наполнитель на основе кизельгура или керамики/силикатной извести.
Избыточное давление в ацетиленовых баллонах составляет обычно не более 17 бар, а давление выхода из баллона — не более 1 бара, а обычно порядка 0,5 бара.
Ацетиленовые баллоны обычно снабжены как обычными предохранительными клапанами, срабатывающими при повышении давления, в том числе проходящем и изотермически, так и особыми предохранительными клапанами, срабатывающими при повышении температуры до уровня выше 100°C, выпуская ацетилен в атмосферу. Такие клапаны действуют, как плавкие вставки.
В России, ацетиленовые баллоны окрашены в белый цвет, с красной надписью «Aцетилен».
Примечания
- ↑ 12
ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия - ↑
А.Л.Лапидус, И.А.Голубева, Ф.Г.Жагфаров. Газохимия. Учебное пособие. — Москва: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1. - ↑
Большая энциклопедия нефти и газа. Неприятный запах — ацетилен. Проверено 10 октября 2013. - ↑
Корольченко, Пожаровзрывоопасность веществ, 2004, с. 198. - ↑
Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72. - ↑
Ацетилен. Проверено 10 октября 2013. - ↑
В России разработали ракетный двигатель на аммиаке — Известия
Ссылки
- Ацетилен // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
| Углеводороды | |
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Гептадекан • Октадекан • Нонадекан • Эйкозан • Докозан • Гектан |
| Алкены | Этилен • Пропен • Бутены • Пентены • Гексены • Гептены • Октен |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен • Циклобутадиен |
| Другие ненасыщеные | Винилацетилен • Диацетилен • Каротин |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан • Инден |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан • Инден |
| Полициклические | Нафталин • Антрацен • Бензантрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
ацетилен, ацетилен + вода, ацетилен википедия, ацетилен вікіпедія, ацетилен гарган авах, ацетилен донецк, ацетилен получение, ацетилен формула, ацетилен хлорирование, ацетиленовий генератор