Что представляет собой
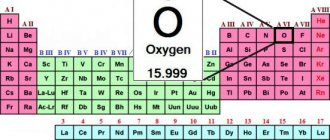
Хром – это металл, элемент таблицы Менделеева №24.
Международное обозначение и формула – Chromium, Cr.
Серебристо-голубоватое блестящее вещество – одно из самых твердых (5,5 по Моосу) и тугоплавких металлов, но хрупко. Относится к чёрным металлам.
Структура, свойства роднят его с железом, марганцем, титаном, никелем. Эти элементы объединены в одно семейство.
Уникальная особенность элемента – ярко-радужная окраска соединений: голубизна, фиолет, зелень до изумрудности, желтизна, оранж, пурпур. Они обусловили название, благодаря им легко отличить хром от других металлов.
По-древнегречески χρῶμα (хрома) – краска, цвет.
История открытия Хром Chromium
Открытие элемента Chromium на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома). Он прокалил зелёный оксид Cr2O3 с углем и выделил тугоплавкий металл (с примесью карбидов). Сам оксид Cr2O3 Воклен получил разложением «Сибирского красного свинца» — минерала крокоита PbCrO4.
Современный способ получения чистого хрома (с 1894 г.) отличается от способа Воклена только видом восстановителя. Процесс электролитического покрытия железа хромом разработан в 20-х годах ХХ в.
Физико-химические характеристики
Физические и химические свойства хрома типичны для металлов:
- Химически малоактивен. В обычных условиях не взаимодействует с водой, растворами щелочей. Реакция запускается при +600°С.
- Кислород создает на его поверхности защитную оксидную пленку.
- В соединениях проявляет три степени: +2, +3, +6. Самые устойчивые – трехвалентные.
Применение хрома затрудняют недостатки:
- Явное ухудшение характеристик примесями в составе.
- Необходимость дополнительной обработки сверхтвердого металла для получения пластичности.
Однако они компенсируются достоинствами металла: тугоплавкостью, твердостью (пятый среди металлов), стойкостью к коррозии.
| Свойства атома | |
| Название, символ, номер | Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) | 51,9961(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Радиус атома | 130 пм |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K (1856,9 °C) |
| Температура кипения | 2945 K (2671,9 °C) |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Нахождение в природе
В природе отмечено два десятка хромовых минералов. Основные – хромит и крокоит.
Изверженные породы содержат разную концентрацию элемента (г/т):
- ультраосновные – 2000;
- базальты, другие основные – 200.
Каждая тонна земной коры содержит в среднем 83 г хрома.
Промышленный интерес представляет один класс – хромшпинелиды.
Металл содержат драгоценные камни – хромтурмалин, уваровит (хромовый гранат), другие.
Загрязнение окружающей среды тяжёлыми металлами
Элементами биосферы, подвергающимся загрязнению тяжёлыми металлами, являются почва и вода. Чаще всего виновниками этого выступают металлургические предприятия, перерабатывающие лёгкие и тяжёлые цветные металлы. Список загрязняющих агентов также пополняют предприятия по сжиганию мусора, автомобильные выхлопы, котельные, химико-производственные, типографические компании и даже электростанции.
Чаще всего токсинами являются: свинец (автомобильное производство), ртуть (пример распространения: разбитые в быту градусники и люминесцентные осветительные приборы), кадмий (образуется в результате сжигания мусора). Кроме этого, большинство заводов в производстве используют тот или иной элемент, который может быть охарактеризован как тяжёлый. Металл группы, список которой был приведен выше, в виде отходов поступает чаще всего в водоёмы и далее по трофической цепи доходит до человека.
Кроме техногенных факторов загрязнения природы тяжёлыми металлами, существуют также природные – это извержения вулканов, в лаве которых обнаружено повышенное содержание кадмия.
Технология получения
Традиционное сырье для получения хрома – хромшпинелиды.
Главные способы получения металла – обогащение руды методом электролиза либо восстановлением.
Для повышения степени чистоты конечного продукта сырье сплавляют в электропечи с содой, добавляя кислород.
Производство металлического хрома почти абсолютной чистоты ведется методом электролиза концентрированных хромовых растворов либо восстановлением оксида хрома алюминием в вакуумных печах (при 1500°C).
Меры предосторожности
Металлический хром и соединения Cr (III), как правило, не считаются опасными для здоровья, но вещества, содержащие Cr (VI), могут быть токсичными, если их принимать внутрь или вдыхать. Большинство таких веществ оказывают раздражающее действие на глаза, кожу и слизистые оболочки. При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента – около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
Так как соединения хрома используются в красителях и для дубления кожи, они часто встречаются в почве и грунтовых водах заброшенных промышленных объектов, требующих экологической очистки и восстановления. Грунтовка, содержащая Cr (VI), до сих пор широко применяется в аэрокосмической промышленности и автомобилестроении.
Где используется
Металл используется по двум направлениям: как лигатура к другим металлам и как покрытие.
Металлургия
Отрасль, забирающая три четверти объемов металла. Хромом легируют стали для улучшения кондиций.
Получают продукт:
- нержавеющий;
- износостойкий;
- жаропрочный.
Такие достоинства сталей обусловили их применение как материала стволов артиллерии, корпусов субмарин, сейфов, металлорежущего, медицинского, химического инструментария. Из них выполнены двигатели космических кораблей, начинка плазмотронов.
Даже незначительное количество хрома в составе кратно улучшает механические свойства материала.
Самые известные хромсодержащие сплавы – с никелем (нихром) и железом (фехраль). Это прецизионные материалы с повышенным электрическим сопротивлением. Используются для работы при экстремальных температурах.
Другие отрасли промышленности
Продукция из металла и сплавов с ним выпускается для разных сегментов рынка:
- Кирпичи – корпус металлургических печей.
- Нагревательные элементы (сплав с никелем).
- Хирургический инструментарий (сплав с никелем, молибденом, кобальтом).
- Соединения хрома пригождаются при производстве спичек, обуви, одежды (знаменитая блестяще-прочная хромовая кожа), окраске текстиля, обработке мебельной древесины.
- Зеленую хромовую краску наносят на керамику перед покрытием глазурью и обжигом.
Краски из перетертых хромовых руд применяли еще иконописцы Древней Руси.
- Трехвалентный оксид металла – исходник при выращивании синтетических рубинов для лазеров.
- Зеленые огни салюта – заслуга хрома.
Хром закупают фармацевтические гиганты, производители биодобавок, препаратов для похудения.
Декор
Хромированное покрытие корпуса часов либо деталей авто – не только маркер статусности. Такая обработка защищает от износа, коррозии, механических повреждений.
Толщина покрытия металлом зависит от назначения изделия: от 2 мкм (декоративный ассортимент) до 0,1 мм (детали байков, велосипедов, авто).
Процесс покрытия хромом называется хромированием. Он технологически прост и недорог.
Бихромат калия
K2Cr2O7 является мощным окислителем и ему отдается предпочтение в качестве средства для очистки лабораторной посуды от органики. Для этого используется его насыщенный раствор в концентрированной серной кислоте. Иногда, однако, его заменяют бихроматом натрия, исходя из более высокой растворимости последнего. Кроме того, он может регулировать процесс окисления органических соединений, преобразуя первичный спирт в альдегид, а затем в углекислоту.
Бихромат калия способен вызвать хромовый дерматит. Хром, вероятно, является причиной сенсибилизации, ведущей к развитию дерматита, особенно рук и предплечий, который носит хронический характер и трудно излечим. Как и другие соединения Cr (VI), бихромат калия канцерогенен. С ним нужно обращаться в перчатках и соответствующими средствами защиты.
Значение для человека
Хром присутствует в организме человека изначально.
Здоровье
Он – участник ряда биологических процессов:
- Липидный, углеродный обмен.
- Выведение «плохого» холестерина
- Баланс сахара в крови.
- Укрепление костной ткани.
- Активация действия инсулина.
- Способность замещать йод.
- Стимуляция регенерации тканей.
Достаточное содержание хрома в организме критично важно для людей с лишним весом, диабетом, заболеваниями щитовидной железы, сердца, сосудов.
Питание
Хромом богаты продукты всех основных групп:
- Мясо – курятина, говядина (и печень);
- Рыба – скумбрия, тунец, сельдь.
- Крупы – манная, перловая.
- Овощи – помидоры, редис, зеленый лук.
Металлом насыщены сыры, бобовые, кукурузное масло, фрукты, хлеб из муки крупного помола, пивные дрожжи.
Дозировка
Ежесуточная потребность в хроме (мкг):
- Дети – 12-34 (в зависимости от возраста).
- Женщины – 55-68.
- Мужчины – 59-79.
При беременности у женщин, активном образе жизни, физических нагрузках у мужчин потребность удваивается.
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Хром |
| 102 | Прежнее название | |
| 103 | Латинское название | Chromium |
| 104 | Английское название | Chromium |
| 105 | Символ | Cr |
| 106 | Атомный номер (номер в таблице) | 24 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, переходный, чёрный металл |
| 109 | Открыт | Луи-Николя Воклен, Франция, 1797 г. |
| 110 | Год открытия | 1797 г. |
| 111 | Внешний вид и пр. | Твёрдый металл голубовато-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 52Cr |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,014 % |
| 120 | Содержание в морях и океанах (по массе) | 6,0·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0015 % |
| 122 | Содержание в Солнце (по массе) | 0,002 % |
| 123 | Содержание в метеоритах (по массе) | 0,3 % |
| 124 | Содержание в организме человека (по массе) | 3,0·10-6 % |