Химическая коррозия металлов – это опасное явление, способное привести к их полному разрушению. Процесс напрямую связан со способностью материала вступать во взаимодействие со средой, представляющей повышенную химическую опасность.
Среди важных свойств протекания химической коррозии металла – параллельный процесс окисления и восстановления. Ученые не отмечают прямой связи с электрическим током, который потенциально может образовываться или воздействовать на участвующие в реакции материалы.
Если рассматривать первопричину распространения такого процесса, то мы быстро придем к выводу – она кроется в термической нестабильности металлов разных типов.
Они склонные под воздействием окислительных компонентов среды быстро переходить в устойчивое состояние и зачастую это происходит полностью непроизвольно.
Процесс окисления и восстановления при протекании химической коррозии происходит на фоне уменьшения потенциала системы. При этом нужно учитывать знаки изменения потенциала, чтобы предсказать риск произвольного запуска такого процесса и его интенсивного протекания внутри материала.
Ученые определяют основным критерием, который стимулирует самопроизвольный процесс, такой показатель, как изобарно-изотермический потенциал G.
Когда реакция начинает протекать произвольно, он значительно убывает. При этом скорость уменьшения может меняться в зависимости от типа материалов, условий коррозионной среды и ряда других ключевых параметров.
Газовая коррозия металлов
Научная статистика показывает, что газовая коррозия металлов протекает наиболее часто. При рассмотрении химической порчи она значительно более распространена, чем жидкостное ржавение при контакте с электролитами.
Важный фактор здесь – высокая температура. Если металл сильно нагрет и на него начинает воздействовать газ, происходит разрушение.
Так как уровень температур должен быть достаточно высок, а при обычном использовании создать условия для протекания такой химической коррозии довольно сложно, процесс часто наблюдается в металлургии.
Из-за этого страдает оборудование, используемое при штамповке, ковке, горячей прокатке и других процессах. Без дополнительной защиты длительность использования подобной техники станет значительно меньше.
Опасность представляет и контакт металла с кислородом. Формула реакции, которая запускается в таком случае, выглядит следующим образом: Ме + 1/2О2 – МеО.
Эта реакция имеет четкое окислительное направление, потому напрямую связана с показателями парциального кислородного давления. Стоит обратить внимание на то, что реакция может быть равновесной, смещенной к образованию оксида, либо протекающей в обратном направлении.
Очень важно понимать, с какой газовой смесью контактирует металл в той области, где вы его используете. Хорошее понимание парциального давления кислорода в смеси даст нам температурный интервал.
Именно в нем будет запускаться окислительный процесс, приводящий к разрушению материала или значительному ухудшению уровня его качества.
Факторы скорости протекания газовой химической коррозии
По мере исследования особенностей процесса протекания химической коррозии, ученые смогли определить важные факторы, которые влияют на ее скорость и другие особенности. К ним относятся такие, как:
- Температура среды, в которую погружен металл.
- Состав сплава и другие особенности металла.
- Особенности газовой среды, ее состав, преобладающие элементы.
- Длительность контактирования материала с коррозийной средой.
- Появляющийся продукт коррозии.
Как и в случае с другими типами коррозийных поражений, большое значение имеет тип и особенности создающейся на поверхности оксидной пленки.
Особенности формирования оксидных пленок при газовой коррозии
Весь процесс формирования оксидной пленки на поверхности металла можно разделить на две крупные стадии:
Абсорбирование молекул кислорода на поверхности металлического изделия
Это происходит на тех участках, которые находятся в непосредственном контакте с атмосферой. Заметно появление ионной связи – атом кислорода забирает у металла по два электрода.
Можно предположить, что формирование очень сильной и стабильной связи при протекании такой реакции связано с попаданием кислорода в особое поле атомов металла.
Когда поверхность материала будет полностью наполнена окислителем, окажется сформирована мономолекулярная пленка. Она имеет склонность к утолщению со временем. Это уменьшает дальнейший контакт с кислородом, но сам опасный коррозийный процесс уже оказывается запущен.
Формирование химического соединения
Это явление характерно для ситуации, в которой происходит активное взаимодействие металла и газа. Из-за воздействия окислительных компонентов сплав начинает активно терять валентные электроны. Стремительно формируются и накапливаются продукты коррозии.
Дальнейшее протекание процесса будет во многом характеризоваться особенностями оксидной пленки. Так если она отличается повышенным уровнем защиты, сам коррозийный процесс будет замедляться.
Виды оксидных пленок
Когда химическая коррозия происходит под действием температуры и газовой среды, могут сформироваться три вида пленок:
- Тонкие. Со стороны заметить их будет невозможно. Они одни из самых не прочных, могут легко стираться под действием механического давления.
- Средние. Могут быть замечены, потому что со стороны металл слегка меняет цвет.
- Толстые. Хорошо заметны невооруженным глазом.
Чтобы не допустить протекание опасных процессов разрушения материала, важно сделать пленку защитной.
Факторы формирования защитной пленки
Оксидная пленка способна оказывать выраженное защитное воздействие на материал. Но для этого требуется, чтобы она соответствовала нескольким важным требованиям:
- Сплошность. На поверхности пленка распределяется ровным слоем, без пор и участков, которые не затронуты ею.
- Хорошее сцепление с поверхностью материала. Это требуется для удержания подобного защитного барьера на месте и исключения ухудшения его свойств.
- Химическая инертность. Пленка будет защищать металл только в том случае, если она вступает в химические реакции с окружающей средой. В противном случае, есть большая опасность, что весь защитный эффект окажется сведен к нулю.
Так как материал будет использоваться на протяжении длительного времени и сложно предсказать, что станет воздействовать на него, большое значение имеет стойкость к износу и повышенный уровень твердости.
Не менее важен и тот факт, чтобы пленка не была пористой и рыхлой. Когда она плохо контактируется с поверхностью, риск протекания разрушающих процессов становится значительно выше.
При изучении различных свойств оксидных пленок, ученые особенно пристально рассматривают сплошность. Отмечается, что на нее влияет молекулярный объем. Его показатели должны быть выше атомного объема металла.
Сплошность не ставится на первое место при определении защитных свойств оксидной пленки только для небольшой группы металлов. В их числе щелочно-земельные и щелочные.
При проведении работ по защите от химической коррозии, большое внимание уделяется методу замера толщины. Анализ характеристик происходит на разных стадиях формирования. Большое значение имеют получаемые показатели скорости окисления металла и характер протекания подобного процесса.
Когда окислы оказываются сформированными, специалисты рекомендуют проверить, какую пленку они создали на поверхности, обладает ли она нужными защитными свойствами.
Способы защиты от коррозии
Методы борьбы с коррозией включают:
- обработку основного металла защитным слоем (например, нанесение краски);
- использование ингибиторов (например, хроматов или арсенитов);
- внедрение материалов, устойчивых к коррозийным процессам.
Выбор конкретного материала зависит от потенциальной эффективности (в том числе технологической и финансовой) его использования.
Современные принципы защиты металла основываются на таких методиках:
- Улучшение химической сопротивляемости материалов. Успешно зарекомендовали себя химически стойкие материалы (высокополимерные пластики, стекло, керамика).
- Изолирование материала от агрессивной среды.
- Уменьшение агрессивности технологической среды. В качестве примеров таких действий можно привести нейтрализацию и удаление кислотности в коррозийных средах, а также использование всевозможных ингибиторов.
- Электрохимическая защита (наложение внешнего тока).
Указанные выше методики подразделяются на две группы:
- Повышение химической сопротивляемости и изолирование применяются до того, как металлоконструкция запускается в эксплуатацию.
- Уменьшение агрессивности среды и электрохимическая защита используются уже в процессе применения изделия из металла. Применение этих двух методик дает возможность внедрять новые способы защиты, в результате которых защита обеспечивается изменением эксплуатационных условий.
Один из самых часто применяемых способов защиты металла — гальваническое антикоррозийное покрытие — экономически нерентабелен при значительных площадях поверхностей. Причина в высоких затратах на подготовительный процесс.
Ведущее место среди способов защиты занимает покрытие металлов лакокрасочными материалами. Популярность такого метода борьбы с коррозией обусловлена совокупностью нескольких факторов:
- высокие защитные свойства (гидрофобность, отталкивание жидкостей, невысокие газопроницаемость и паропроницаемость);
- технологичность;
- широкие возможности для декоративных решений;
- ремонтопригодность;
- экономическая оправданность.
В то же время, использование широкодоступных материалов не лишено недостатков:
- неполное увлажнение металлической поверхности;
- нарушенное сцепление покрытия с основным металлом, что ведет к скапливанию электролита под антикоррозийным покрытием и, таким образом, способствует коррозии;
- пористость, приводящая к повышенной влагопроницаемости.
И все же, окрашенная поверхность защищает металл от коррозийных процессов даже при фрагментарном повреждении пленки, тогда как несовершенные гальванические покрытия способны даже ускорять коррозию.
Химическая коррозия в жидкостях-неэлектролитах
Хотя газовая коррозия считается наиболее распространенной, порчу металла при контакте с различными жидкостями-электролитами также не стоит сбрасывать со счетов. Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Их делят на две крупные группы – органические и неорганические. Электролитов, представляющих большую опасность для металла, много – от расплавленной серы и бензола до жидкого брома, спирта, керосина, нефти и других.
Большое значение при протекании химической реакции играет чистота электролита. Когда он полностью чист, взаимодействия не наблюдается. Но стоит только попасть в состав небольшому количеству примесей, реакция начинает развиваться особенно стремительно.
Еще один дополнительный фактор риска – присутствие влаги. Тогда к опасности химической коррозии также прибавляется и угроза электрохимической.
Применение антикоррозийных термостойких покрытий
Данный способ также заключается в уменьшении скорости коррозийного процесса, но за счет специальных термостойких покрытий. Обычно используется техника нанесения железоалюминиевых термодиффузионных слоев, которая известна как термохромирование. Эффективную защиту обеспечивает и металлокерамическая обработка металлических деталей и конструкций. К преимуществам такой защиты от газовой коррозии можно отнести не только надежное термо- и механическое покрытие, но и возможность гибкой модификации физико-химических свойств оболочки. В составе функционального слоя могут задействоваться и тугоплавкие окислы, и металлические компоненты наподобие молибдена и вольфрама.
Стадии протекания коррозии в жидкостях-неэлектролитах
Если рассматривать весь процесс более подробно и анализировать, что влияет на скорость химической коррозии, можно выделить несколько стадий ее протекания:
- Контакт окислителя с поверхностью материала.
- Запуск процесса хемосорбции реагента на поверхности.
- Протекание реакции металла и окислителя, формирование оксидной пленки.
Условия среды, состав сплава и самого электролита могут повлиять на протекание нескольких основных процессов. К ним относятся такие, как десорбция оксидов с металлом и диффузия оксидов в неэлектролит. Но оба процесса также могут и не наблюдаться.
Чтобы не допустить запуска коррозии в жидкостях-электролитах, стоит позаботиться о нанесении на поверхность специальных защитных составов. Важно, чтобы на протяжении всего времени использования изделия они полностью сохраняли свою целостность.
Защитная атмосфера как средство борьбы с коррозией
Еще одна методика предохранения металлических заготовок и сплавов от поражения коррозии в результате газового окисления. Защитные атмосферы могут формироваться средами аргона, азота и углерода. Для каждого металла применяются конкретные газовые смеси. Например, чугун защищается аргоном или углекислотными составами, а сталь хорошо взаимодействует с водородом и азотом. В обслуживании магистральных трубопроводов такого рода защита применяется в основном при выполнении монтажных сварочных мероприятий. В постоянном режиме эксплуатации чаще используют электротехническую защиту газовых сетей от коррозии, которая технически выполняется полупроводниками с кабельными контурами. Это разновидность электрохимической противокоррозийной оболочки, включающая в структуру элементы анодо-протектной гальванической защиты.
Факторы протекания химической коррозии
Большое значение при рассмотрении процесса химической коррозии металлов имеет определение факторов, оказывающих на нее влияние. К ним относятся такие, как:
Температура
Все окислительные процессы протекают быстрее, если температура сильно увеличивается.
Температурный режим
В особой группе риска оказываются металлические изделия, которые на протяжении определенного времени начинают охлаждаться и нагреваться попеременно. В таком случае сильно страдает защитная пленка. Она начинает трескаться, в местах, где это происходит, металл контактирует со средой, запускается повторное окисление. Новая пленка также формируется на фоне постепенного отслоения старой.
Состав среды
Это относится как к газам, так и к электролитам в жидком виде. Как уже было отмечено выше, даже небольшие загрязнения жидкости могут привести к тому, что скорость коррозийного повреждения станет значительно выше.
Состав сплава
В сплав металла добавляют различные компоненты, которые могут, как затормозить, так и ускорить окисление. К примеру, сильными замедлителями признаны такие добавки, как титан, медь и кобальт. Хорошо влияют на уменьшение скорости протекания процесса хром и алюминий.
Тип обработки поверхности
Ученые во время исследований показали, что гладкая поверхность отличается заметно более высокой устойчивостью к окислению, процесс протекает медленнее. Если же на поверхности металла много бугров, есть выраженные дефекты, стоит готовиться к более быстрому протеканию.
Структура материала
Уравнение химической коррозии показывает, что значительное замедление коррозийного процесса характерно для металлов с аустенитной структурой.
Химическая коррозия. Жидкостная и газовая коррозия
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 16.04.2019 |
- Данный тип работы не является научным трудом, не является готовой выпускной квалификационной работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
| Много готовых курсовых работ по химии |
Посмотрите похожие темы возможно они вам могут быть полезны:
| Законы электролиза. Применение электролиза в химической технологии |
| Коррозия металлов. Основные механизмы и виды коррозийных разрушений |
| Атмосферная коррозия металлов и способы защиты от атмосферной коррозии |
| Электрохимическая коррозия металлов и сплавов |
Введение:
Металлы и металлические сплавы являются основными конструкционными материалами для большинства отраслей экономики. Их широкое внедрение в промышленное строительство и транспорт имело место на рубеже XVIII-XIX. В это время появился первый чугунный мост, спущен на воду первый корабль, корпус которого был сделан из стали, и были созданы первые железные дороги. Начало практического использования человеком железа восходит к 9 веку до нашей эры. Именно в этот период человечество перешло от бронзового века к железному веку. В XXI веке высокие темпы промышленного развития, интенсификация производственных процессов, повышение основных технологических параметров (температуры, давления, концентрации реагентов и т. д.)предъявляют высокие требования к надежной работе технологического оборудования и строительных конструкций. Особое место в комплексе мероприятий по обеспечению бесперебойной работы оборудования отводится его надежной защите от коррозии и использованию в этом отношении высококачественных химически стойких материалов.
Коррозия металлов — это самопроизвольный процесс, всегда отрицательный с точки зрения производственной практики. Однако можно привести примеры, когда коррозия играет положительную роль и умышленно провоцируется, например, во время кислотной очистки металлических поверхностей. Иногда под термином «коррозия металлов» понимается не только сам процесс, но и его результат — разрушение.
Коррозия — это физико-химическое взаимодействие между металлом и средой, в результате которого изменяются свойства металла, среды или технической системы, которая их включает. Коррозийная среда называется коррозийной или едкой. В результате взаимодействия металла и агрессивной среды образуется химическое соединение, называемое продуктом коррозии.
Виды коррозионных повреждений
Разрушение металлов и сплавов может происходить в результате химического (химическая коррозия, неэлектрохимическая), электрохимического (электрохимическая коррозия), биологического (микробиологическая или микробная коррозия) и радиационного (радиационная коррозия) воздействия внешней среды. Способность металлов противостоять коррозийному воздействию внешней среды называется коррозионной стойкостью.
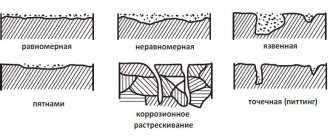
По характеру коррозионного повреждения, непрерывного или общего, коррозия различается и локальная или локальная. Непрерывная коррозия равномерна и неравномерна. Равномерное разрушение может произойти, когда поверхность металла и свойства агрессивной среды, действующей на эту поверхность, являются однородными. В реальных условиях процессы коррозии чаще встречаются на неоднородной (неоднородной) металлической поверхности в неоднородной агрессивной среде. Поэтому на практике они обычно имеют дело с неравномерной коррозией и с различными типами локальной коррозии.
Коррозию называют равномерной, если фронт коррозионного разрушения распространяется параллельно плоскости металла, и неоднородной, если скорость коррозии в разных областях не одинакова. Примером равномерной коррозии является селективная коррозия, которая характерна для сплавов — твердых растворов. Он заключается в разрушении одного из компонентов сплава.
Таким образом, при коррозии латуни цинк может равномерно разрушаться, ионизироваться и переходить в раствор, и в результате поверхностный слой обогащается медью.
Локализованная коррозия имеет ряд разновидностей, среди которых наиболее распространены следующие:
- коррозия пятнами в виде отдельных оболочек наименее неровная;
- точечная или точечная коррозия — разрушение в глубине металла с образованием пор, вплоть до сквозных;
- межкристаллитная коррозия — разрушение металла по границам кристаллов. В этом случае внешних проявлений процесса может не наблюдаться;
- внутрикристаллическая коррозия — разрушение металла по зернам кристаллитов. Этот тип коррозии наблюдается при растрескивании под воздействием внешних механических или внутренних напряжений.
Локализованная коррозия может быть определена как коррозия, которая происходит на части поверхности металла со значительно более высокой скоростью, чем на остальной поверхности. В частности, точечная (точечная) коррозия связана с разрушением оксидной пленки и часто происходит на совершенно гладкой поверхности, где защитная оксидная пленка на металле подвержена только локальному разрушению, а в остальном устойчива к раствору который действует на металл. Точечные повреждения (ямки) возникают в неоднородностях оксидной пленки при наиболее подходящих местных условиях окружающей среды.
Питтинг может происходить на поверхности всех металлов. На практике это чаще встречается в пассивных сплавах, в которых из-за высокопрочной пленки коррозия становится локальной. Одной из причин образования ям может быть присутствие в агрессивной среде ионов-активаторов, таких как ионы Cl-, Br-, CN- и т. д. Питтинг-коррозия опасна, поскольку при низких коррозионных потерях структура может быть отключенным в довольно короткий промежуток времени. Чаще всего этот тип коррозионных повреждений возникает при эксплуатации изделий из алюминия, нержавеющей стали и сплавов, содержащих никель, хром и другие металлы, склонные к пассивации.
Межкристаллитная коррозия (ICC) вызвана тем, что границы зерен, даже в чистом металле, более подвержены коррозии, чем само зерно. Атомы металла на границах зерен имеют плотную и менее упорядоченную упаковку; примеси концентрируются на границах зерен, что дополнительно снижает их устойчивость к агрессивным средам. Разрушение границ зерна наиболее опасно при эксплуатации металлических изделий под напряжением. В этих условиях наблюдается так называемое межзеренное растрескивание. Алюминий и аустенитные нержавеющие стали более подвержены этому типу повреждений. Для уменьшения склонности к МКЦ в стали вводятся стабилизирующие элементы Ti, Nb, что предотвращает образование карбидов хрома, однако в сварных конструкциях возможно появление ножевой коррозии — быстрое разрушение в узкой зоне вдоль сварных швов при окислении сред.
Когда металл подвергается переменным напряжениям, в нем появляются трещины, которые постепенно развиваются. Эта неудача называется усталостным переломом. При наличии агрессивной среды этот процесс ускоряется. Этот эффект обнаруживается даже в умеренно агрессивных средах. Например, усталостная долговечность алюминия значительно уменьшается в присутствии влаги. Очень трудно защитить металлы от этого типа коррозийного воздействия. Рекомендуемые методы защиты (металлические покрытия, анодирование, окраска и т. д.) Следует применять осторожно, с учетом физико-механических свойств защитного слоя.
Химическая коррозия
Химическая коррозия — это тип коррозионного разрушения металла, связанный с взаимодействием металла и агрессивной среды, в которой металл одновременно окисляется и коррозионная среда восстанавливается. Химическая коррозия не связана с образованием, а также воздействием электрического тока.
Движущей силой (основной причиной) химической коррозии является термодинамическая нестабильность металлов. Они могут самопроизвольно переходить в более стабильное состояние в результате процесса: Металл + Окисляющий компонент среды = Продукт реакции.
В этом случае термодинамический потенциал системы уменьшается.
Знак изменения термодинамического потенциала можно использовать для определения возможности самопроизвольной химической коррозии. Критерием обычно является изобарически-изотермический потенциал G. Когда химический процесс происходит самопроизвольно, наблюдается уменьшение изобарически-изотермического потенциала.
Следовательно, если:
- Д GT <0, тогда возможен процесс химической коррозии;
- Д GT> 0, тогда процесс химической коррозии невозможен;
- Д GT = 0, то система находится в равновесии.
Химическая коррозия включает в себя:
- Коррозия в неэлектролитных жидкостях;
- Газовая коррозия — коррозия, когда металл вступает в контакт с сухими газами при высоких температурах (например, коррозия металлов в двигателях внутреннего сгорания, камерах сгорания, струйных соплах под воздействием газовых продуктов сгорания топлива).
Химическая коррозия в неэлектролитных жидкостях
Неэлектролитные жидкости — это жидкие среды, которые не являются проводниками электричества. К ним относятся: органические (бензол, фенол, хлороформ, спирты, керосин, масло, бензин); неорганического происхождения (жидкий бром, расплавленная сера и т. д.). Чистые неэлектролиты не реагируют с металлами, но с добавлением даже небольшого количества примесей процесс взаимодействия резко ускоряется.
Коррозия в жидких неэлектролитах сводится к химической реакции с веществом:
- Me + Br2 (жидкость)> MeBr2;
- Me + S (расплав)> MeS.
Сера является едким веществом для химической коррозии в жидком топливе. Сера в расплавленном состоянии реагирует практически со всеми металлами, значительно разрушая олово, свинец, медь, малоуглеродистые стали и титан, а также незначительно — алюминий. Чем тяжелее фракция дистилляции в ряду бензин — керосин — мазут, тем выше содержание серы. Различные соединения серы взаимодействуют по-разному. Сероводород образует нерастворимые соединения со многими металлами — сульфиды.
Элементарная сера также образует сульфиды при взаимодействии с металлами. Органические соединения, содержащие серу (меркаптаны R-SH), взаимодействуют с металлами с образованием металлоорганических производных — меркаптидов.
Присутствие воды увеличивает коррозионную активность сырой нефти, содержащей тиоалкоголи и сероводород. Бензин прямой перегонки в отсутствие воды практически не оказывает коррозионного воздействия на черные сплавы. Треснувшие бензины при взаимодействии с металлами смолятся, кислотность среды возрастает, что способствует коррозии.
Если, кроме того, температура поднимется, в жидкости будет растворен кислород — химическая коррозия усилится. Наличие влаги в неэлектролитных жидкостях обеспечивает интенсивную коррозию уже по электрохимическому механизму. Например, когда четыреххлористый углерод содержит следы воды, скорость коррозии стали резко возрастает: CCl4 + H2O = CCl3OH + HCl что связано с образованием агрессивных продуктов при гидролизе. Даже безводные хлорированные органические растворители разрушаются алюминием.
Химическая коррозия в неэлектролитных жидкостях подразделяется на несколько этапов:
- приближение окислителя к поверхности металла;
- хемосорбция реагента на поверхности;
- реакция окислителя с металлом (образование оксидной пленки);
- десорбция оксидов металлом (может отсутствовать);
- диффузия оксидов в неэлектролит (может отсутствовать).
Для защиты конструкций от химической коррозии в неэлектролитных жидкостях на его поверхность наносятся покрытия, устойчивые в этой среде.
Газовая коррозия
Наиболее распространенным случаем химической коррозии является окисление металлов различными газами. Это происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Сопла ракетных двигателей, арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин подвергаются газовой коррозии. Металлы подвергаются газовой коррозии при их термической обработке.
Газообразные агрессивные агенты включают O2, CO2, SO2, H2O, H2S, Cl2. Для реакции окисления металла кислородом 2Metv + O2 (г) = 2MeRef.
Они не имеют такой же агрессивности по отношению к металлам. Скорость окисления увеличивается в ряду H2O> CO2> O2> SO2 (при температуре 900 ° C для железа, кобальта, никеля). Более того, в атмосфере этих газов скорость коррозии уменьшается до порядка Fe> Co> Ni.
Уравнения для этих процессов окисления:
- Fe + H2O> FeO + H2
- Fe + CO2> FeO + CO
- Fe + H2O + SO2> FeSO3 + H2
- 2Fe + O2> 2FeO
- 3Fe + SO2> 2FeO + FeS.
Механизм газовой коррозии обусловлен возникновением двух сопряженных реакций на границе раздела между твердой и газовой фазами. Одним из них является окисление металла, другим является восстановление газообразного окислителя, и эти процессы не разделяются в пространстве. Продукты реакции окисления накапливаются там же. В процессе образования продуктов коррозии атомы и ионы металлов, с одной стороны, и атомы или ионы кислорода, с другой, диффундируют через постепенно утолщающуюся пленку продуктов коррозии. В результате на поверхности металла образуются соответствующие соединения, например, оксиды, сульфиды.
Подвергаются газовой коррозии сталь, чугун, железо, которые взаимодействуют с кислородом. Они теряют прочность и твердость, особенно при температурах выше 300 ° С. В этом случае продукты образуются в соответствии с реакцией: Fe + O2> FeO + Fe3O4 + Fe2O3.
Полученная смесь продуктов называется дроссом. В то же время обезуглероживание металлов происходит: Fe3C + O2> Fe + CO2.
Обезуглероживание также происходит в атмосфере водорода: Fe3C + 2H2> 3Fe + CH4 ^.
Термодинамика химической коррозии металлов
Как указывалось выше, основной причиной химической коррозии металлов является их термодинамическая нестабильность в различных средах при данных внешних условиях, в результате чего металлы самопроизвольно переходят в более стабильное окисленное (ионное) состояние. Этот процесс сопровождается уменьшением термодинамического потенциала. Свободная энергия Гиббса DG может быть использована в качестве критерия равновесия и спонтанности процессов коррозии металлов, происходящих при постоянных температурах и давлениях. В этих условиях процесс химической коррозии возможен, если DG <0; процесс коррозии невозможен, если DG> 0; система находится в равновесии, если ДG = 0.
Суждение о термодинамической возможности или невозможности процесса может быть сделано непосредственно на основе сравнения парциального давления кислорода в агрессивной газовой среде и давления диссоциации полученного оксида PMeO. Для реакции окисления металла (5) изменение свободной энергии Гиббса может быть определено уравнением изотермы.
POO2, PO2 — равновесное и неравновесное давление кислорода соответственно. При нормальных атмосферных условиях PO2 является парциальным давлением кислорода и составляет ~ 0,21 атм. Равновесное давление кислорода P0O2 равно давлению диссоциации (эластичности) получаемого оксида PMeO. Поскольку для большинства технически важных металлов эластичность диссоциации их оксидов POO2 до температур плавления на несколько порядков меньше 0,21 атм, значение DG является отрицательным, и реакция окисления металла протекает самопроизвольно. Только благородные металлы — золото, платина, палладий, иридий — имеют POO2> 0,21 атм при нормальных атмосферных условиях. и устойчивы к окислению. Все остальные металлы нестабильны.
Кинетика химической коррозии
Кинетика химической коррозии изучает закономерности роста пленки на металлах. Эти законы выражаются математическими зависимостями вида h = f (f), где h — толщина пленки продукта коррозии; ф — время. Истинная скорость коррозии металла будет определяться производной dh / df.
Процессы газовой коррозии представляют собой многоступенчатые гетерогенные процессы, происходящие на границе раздела металл-газ.
Когда металл взаимодействует с газообразными веществами, что сопровождается образованием пористой оксидной пленки на поверхности металла, можно выделить следующие последовательные стадии:
- транспортировка газов до границы раздела;
- адсорбция газа на поверхности металла;
- химическое взаимодействие;
- удаление продуктов коррозии.
Пористая пленка роста. Пористые рыхлые пленки не защищают металл от коррозии, поскольку окисляющий газ легко проникает через поры на его поверхность и вступает в химическое взаимодействие. Скорость реакции в этом случае не зависит от толщины образующейся пленки.
Уравнение прямой называется линейным законом роста пленки. В нем a = h при φ = 0. Согласно этому закону щелочные и щелочноземельные металлы окисляются.
Непрерывный рост пленки. Непрерывные, плотные пленки продуктов коррозии на металлах являются защитными и препятствуют проникновению реагентов — металла и окислителя — навстречу друг другу.
Когда на поверхности металла образуется сплошная (защитная) пленка, процесс можно разделить на следующие отдельные этапы:
- переход металла в форме ионов и электронов из металлической фазы в оксид;
- движение ионов металлов и электронов в оксидном слое;
- транспортировка кислорода к поверхности оксидной пленки;
- ионизация адсорбированного кислорода;
- движение ионов кислорода в оксидном слое;
- химическое взаимодействие с образованием оксида.
Рост таких пленок сопровождается само замедлением процесса, уменьшением скорости коррозии по мере утолщения пленки. Рост тонких оксидных пленок при низких температурах и на первых стадиях окисления металла при высоких температурах сопровождается сильной саморазвитостью. Логарифмический закон соответствует этому случаю.
Защитные свойства пленки определяются рядом факторов, непрерывность которых является необходимым, но не достаточным условием. Оксидная пленка должна иметь хорошую адгезию к основанию, металлу и быть достаточно эластичной и прочной. Коэффициенты теплового расширения металла и оксидной пленки должны быть близки по величине, чтобы предотвратить растрескивание пленок. Оксидная пленка должна быть очень устойчивой к коррозии. Отношение Пиллинга — Бедворта используется для характеристики непрерывности оксидных пленок. Если VOKC / VMe 1, то пленка может быть непрерывной. В этом отношении V0KC представляет собой объем соединения металл-кислород (или другой окислитель); VMe — это объем металла, используемого для образования V0KC.
Механизм химической коррозии
Характер реагентов, их физическое состояние, включая степень дисперсности и степень дефектности твердых фаз, давление газообразной среды и температуру, играют существенную роль в механизме процесса. Когда чистая металлическая поверхность окисляется в воздушной атмосфере, основной причиной всех явлений в пограничном слое следует считать адсорбцию кислорода.
Поскольку кислород является сильным окислителем, эта адсорбция даже при низких температурах носит химический характер, то есть сопровождается разрывом связи в молекуле кислорода и ионизацией образующихся атомов:
- O2 (г) = O2 (адс);
- O2 (реклама) = 2O (реклама);
- O (реклама) + s (Me) = O- (реклама).
В результате на поверхности металла, прилегающей к катионному слою, появляется слой отрицательно заряженных ионов. Внутри пограничного слоя появляется градиент электронного потенциала, достигающий 107 В / Ом.
Мотт и Кабрера первыми объяснили появление оксидных пленок на металлах при низких температурах, когда диффузия практически отсутствует, под действием сильного электрического поля. Утолщение пленки до нескольких десятков нанометров приводит к резкому уменьшению градиента электрического потенциала, и энергии поля оказывается недостаточно для роста оксидного слоя. Процесс окисления останавливается. Дальнейшее окисление возможно только при более высоких температурах, когда термодиффузия становится решающей.
Оксидная пленка, первоначально появляющаяся на поверхности металла, имеет особенность, заключающуюся в том, что ее структура подвергается определенному ориентирующему действию поверхностных атомов подложки. Явление ориентационного и размерного соответствия новообразованной кристаллической фазы на поверхности старой называется эпитаксией. Так, П. Д. Данков и его коллеги обнаружили, что при окислении железа ориентационное соответствие осуществляется с образованием FeO, Fe3O4 и g-Fe2O3 на b-Fe; Fe3O4 на FeO, г — Fe2O3 на Fe3O4. Эпитаксиальное соответствие определяет легкость формирования новых кристаллических структур не только с чисто геометрической стороны, но и с энергетической стороны, т.е. соответствует принципу наименьшего энергопотребления при формировании новой решетки. По мере того как оксидный слой сгущается, действие сил ориентации ослабевает, и оксид имеет тенденцию принимать структуру, устойчивую к этим условиям. Как правило, в атомных слоях окалины химический состав неоднороден: содержание металла уменьшается по направлению к внешней поверхности, а содержание кислорода увеличивается. Так, на железе и стали с длительным окислением выше 850 ° К макроскопические слои различного фазового состава находятся в последовательности: Fe> FeO> Fe3O4> r-Fe2O3> b-Fe2O3. При повышении температуры диффузия является определяющим процессом образования оксидных слоев. Диффузия в твердых телах, при которой в расположении частиц существует дальний порядок, имеет некоторые отличительные особенности.
Это может происходить по следующим механизмам:
- обмен ионами или атомами местами;
- движение по междоузлиям;
- движение по вакансиям.
Первый механизм связан с большими энергетическими трудностями и поэтому маловероятен. Второй и третий механизмы более вероятны, так как они обусловлены наличием реальных дефектов в кристаллах (дефекты по Френкелю и Шоттки).
Влияние внешних и внутренних факторов на скорость химической коррозии
Внешние факторы связаны с составом агрессивной среды и условиями коррозии (температура, давление, скорость среды и т. д.). Внутренние факторы — это факторы, связанные с природой металла, составом и структурой сплава, характером обработки поверхности и т. д. Температура сильно влияет на скорость химической (газовой) коррозии металлов. С повышением температуры процессы окисления протекают гораздо быстрее. Температурная зависимость скорости коррозии количественно выражается уравнением Аррениуса: где K — константа скорости химической реакции при кинетическом контроле процессов или коэффициент диффузии при контроле диффузии; А — предэкспоненциальный фактор; Е — энергия активации химической реакции или диффузии; R — универсальная газовая постоянная; Т — температура по шкале Кельвина. Колебания температуры, особенно попеременное нагревание и охлаждение, увеличивают скорость окисления металла, поскольку в защитной оксидной пленке образуются трещины из-за термических напряжений, и она может отслаиваться. Состав газовой среды. Газовая среда оказывает значительное влияние на скорость коррозии, и этот эффект является специфическим. Например, никель относительно стабилен в средах O2, H2O, CO2 и сильно корродирует в средах SO2. Медь активно окисляется кислородом воздуха, но она стабильна в атмосфере SO2, в то время как хром обладает высокой термостойкостью во всех вышеперечисленных средах. Состав газовой среды оказывает большое влияние на скорость окисления железа и стали. O2, соединения серы и водяного пара особенно пострадали.
Скорость движения газовой среды оказывает заметное влияние на газовую коррозию только на самых начальных стадиях окисления. Это эквивалентно увеличению парциального давления окислителя. Очень высокие скорости могут разрушать защитные пленки и ускорять газовую коррозию.
Сплавная композиция. Оказывая прямое влияние на защитные свойства пленок изделий, некоторые компоненты сплавов приводят к снижению скорости окисления, другие, напротив, к ускорению окисления, тогда как другие практически не влияют на скорость окисления.
Что касается наиболее важного и распространенного конструкционного материала — сплавов на основе железа — можно отметить следующие: S, P, Mn — практически не влияют на скорость химической коррозии; Be, Ti, Co, Ni — значительно замедляют окисление железа, что связано с повышением защитных свойств образующейся окалины; Cr, A1 и Si — значительно замедляют окисление стали из-за образования высокозащитных оксидных пленок, они широко используются для легирования стали с целью повышения ее жаростойкости; V, Mo, W — могут ускорять окисление стали при высоких температурах, благодаря плавкости и летучести образующихся оксидов. Металлическая конструкция. Увеличение дефектности структуры металла приводит к ускорению окисления.
Деформация металла несколько ускоряет окисление на начальных стадиях из-за увеличения энергии металла и влияния на структуру первичной оксидной пленки.
Характер обработки поверхности металла влияет в основном на скорость начальных стадий окисления. Чем тщательнее обрабатывается поверхность металла, тем ниже скорость его окисления.
Защита металлов от химической (газовой) коррозии
Основными способами снижения скорости газовой коррозии металлов являются термостойкое легирование и нанесение защитных покрытий. Термостойкое легирование.
В теории термостойкого легирования существует два механизма формирования защитных пленок:
- формирование защитного слоя из легирующего элемента. Согласно этой теории, защитный оксид легирующего элемента образуется на поверхности сплава, что замедляет диффузию реагентов и окисление основного металла. Эта теория хорошо согласуется с рядом случаев окисления сплавов и позволяет на основе знания некоторых свойств элементов и их оксидов качественно оценить возможность повышения термостойкости при легировании;
- образование высокозащитных двойных оксидов. Согласно этой теории, наиболее полно сформулирован В.И. Архаров, легирующий элемент может образовывать двойные оксиды с основным металлом — таким как шпинель, например, MeMe2O4, которые обладают повышенными защитными свойствами. Основными легирующими элементами для железа являются Cr, Ni, Si, A1. Они способствуют образованию двойных оксидов шпинельной структуры с плотной упаковкой и малыми параметрами решетки, например: Fe2Cr2O4, FeAl2O4, NiFe2O, NiCr2O4. Рассмотренные теории жаропрочного легирования не исключают, а дополняют друг друга и позволяют более рационально подходить к разработке рецептур новых жаропрочных сплавов.
Вывод:
Коррозия приводит к убыткам в миллиарды долларов каждый год, и решение этой проблемы является важной задачей. Основной ущерб, вызванный коррозией, заключается не в потере металла как таковой, а в огромной стоимости продуктов, разрушаемых в результате коррозии. Вот почему ежегодные потери от этого в промышленно развитых странах так велики. Истинные потери от этого не могут быть определены путем оценки только прямых потерь, которые включают стоимость разрушенного сооружения, стоимость замены оборудования и стоимость мер по защите от коррозии. Косвенные убытки наносят еще больший ущерб. Это простои оборудования при замене корродированных деталей и узлов, утечка продукта, нарушение технологических процессов.
Идеальная защита от коррозии на 80% обеспечивается правильной подготовкой поверхности, и только 20% — качеством используемых лакокрасочных материалов и способом их нанесения.
Подведем итоги
В этой статье мы рассмотрели виды химической коррозии и то, чем она отличается от электрохимической. При условии соблюдения ряда требований, удается заметно уменьшить риск разрушения металла. К ним относятся такие, как:
- Контроль формирования защитной оксидной пленки.
- Исключение контакта определенных материалов с агрессивными средами.
- Использование дополнительных защитных покрытий.
- Отслеживание состава газовой смеси или электролита.
- Применение металлов с компонентами сплава, замедляющими реакцию.
Соблюдение перечисленных требований позволит значительно увеличить длительность использования вашего металлического изделия.
Вернуться к статьям Поделиться статьей
Органосиликатные покрытия
Для качественной защиты от коррозии рекомендуется применение металлов с высоким уровнем гидрофобности, непроницаемости в водных, газовых и паровых средах. К числу таких материалов относятся органосиликаты.
Химическая коррозия практически не распространяется на органосиликатные материалы. Причины этого кроются в повышенной химической устойчивости таких композиций, их стойкости к свету, гидрофобных качествах и невысоком водопоглощении. Также органосиликаты устойчивы к низким температурам, обладают хорошими адгезивными свойствами и износостойкостью.
Проблемы разрушения металлов из-за воздействия коррозии не исчезают, несмотря на развитие технологий борьбы с ними. Причина в постоянном возрастании объемов производства металлов и все более сложных условий эксплуатации изделий из них. Окончательно решить проблему на данном этапе нельзя, поэтому усилия ученых сосредоточены на поисках возможностей по замедлению коррозионных процессов.