Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое диоксид углерода
При атмосферном давлении и комнатной температуре диоксид углерода находится в газообразном состоянии. Это наиболее часто встречающаяся его форма, в ней он участвует в процессах дыхания, фотосинтеза и обмена веществ живых организмов.
Диоксид углерода
При охлаждении до -78 °С он, минуя жидкую фазу, кристаллизуется и образует так называемый «сухой лед», широко применяемый как безопасный хладагент в пищевой и химической промышленности и в уличной торговле и рефрижераторных перевозках.
При особых условиях — давлении в десятки атмосфер — углекислота переходит в жидкое агрегатное состояние. Это происходит на морском дне, на глубине свыше 600 м.
Охлаждение и заморозка продуктов
Наряду с жидким азотом жидкий диоксид углерода наиболее подходит для прямого контактного замораживания различных видов продуктов. Как контактный хладагент он привлекателен дешевизной, химической инертностью и термической стабильностью, не вызывает коррозию, не горюч, не опасен для персонала.
Использование СО2 в контактных скороморозильных аппаратах даёт ряд принципиальных преимуществ по сравнению с традиционными технологиями заморозки: время заморозки сокращается до 5 — 30 мин.; быстро прекращается ферментативная активность в замораживаемом продукте; хорошо сохраняется структура тканей и клетки продукта, поскольку кристаллы льда формируются значительно меньших размеров и практически одновременно в клетках и в межклеточном пространстве тканей; при медленной заморозке в продукте появляются следы жизнедеятельности бактерий, в то время как при шоковой заморозке диоксидом углерода они просто не успевают развиться; потери массы продукта в результате усушки составляют всего 0,3 — 1 % против 3 — 6 %; легко улетучивающиеся ценные ароматические вещества сохраняются в больших количествах.
По сравнению с замораживанием жидким азотом при использовании диоксида углерода не наблюдается растрескивание продукта из-за слишком большого перепада температуры между поверхностью и сердцевиной замораживаемого продукта; в процессе замораживания СО2 проникает в продукт и поэтому во время размораживания защищает его от окисления и развития микроорганизмов.
Плоды и овощи, подвергнутые быстрой заморозке и фасовке на месте, наиболее полно сохраняют вкусовые качества и питательную ценность, все витамины и биологически активные вещества, что даёт возможность широко применять их в производствах продуктов для детского и диетического питания.
Часто диоксид углерода используется для быстрого охлаждения свежих пищевых продуктов в упакованном и неупакованном виде до 2 — 6 °С, что улучшает естественный цвет продукта вследствие небольшой диффузии СО2 внутрь продукта. Кроме этого, значительно увеличивается срок хранения продуктов, так как СО2 подавляет развитие как аэробных, так и анаэробных бактерий и плесневых грибков.
В холодильной промышленности СО2 применяется в качестве альтернативного хладагента. Диоксид углерода является эффективным хладагентом, поскольку имеет низкую критическую температуру (+31,1 °С), сравнительно высокую температуру тройной точки (-56 °С), большое давление в тройной точке (0,5 МПа) и высокое критическое давление (7,39 МПа). Как хладагент СО2 обладает следующими преимуществами: очень низкая стоимость по сравнению с другими хладагентами; нетоксичен, не горюч и невзрывоопасен; совместим со всеми электроизоляционными и конструкционными материалами; не разрушает озоновый слой; вносит (удельно) умеренный вклад в увеличение парникового эффекта по сравнению с современными галоидопроизводными хладагентами.
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В состав молекулы вещества входит один атом углерода и два атома кислорода. Химическая формула углекислого газа записывается как CO2
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.
Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO2.
Основные области применения СО 2 :
- в машиностроении и строительстве (для сварки и прочее);
- для холодной посадки частей машин;
- в процессах тонкой заточки;
- для электросварки, основанной на принципе защиты расплавленного металла от вредного воздействия атмосферного воздуха;
- в металлургии;
- продувка углекислым газом литейных форм;
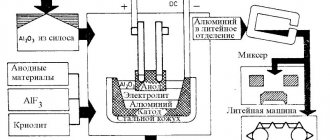
- при производстве алюминия и других легкоокисляющихся металлов;
- в сельском хозяйстве для создания искусственного дождя;
- в экологии заменяет сильнодействующие минеральные кислоты для нейтрализации щелочной отбросной воды;
- в изготовлении противопожарных средств;
- применяется в углекислотных огнетушителях в качестве огнетушащего вещества, эффективно останавливает процесс горения;
- в парфюмерии при изготовлении духов;
- в горнодобывающей промышленности;
- при методе беспламенного взрыва горных пород;
- в пищевой промышленности;
- используется как консервант и обозначается на упаковке кодом Е290;
- в качестве разрыхлителя теста;
- для производства газированных напитков;
Углекислый газ в природе естественные источники
К таким источникам относятся окислительные процессы разной интенсивности:
- Дыхание живых организмов. Из школьного курса химии и ботаники все помнят, что в ходе фотосинтеза растения поглощают углекислый газ и выделяют кислород. Но не все помнят, что это происходит только днем, при достаточном уровне освещения. В темное время суток растения наоборот, поглощают кислород и выделяют углекислый газ. Так что попытка улучшить качество воздуха в комнате, превращая ее в заросли фикусов и герани может сыграть злую шутку.
- Извержения и другая вулканическая активность. CO2 выбрасывается из глубин мантии Земли вместе с вулканическими газами. В долинах рядом с источниками извержений газа настолько много, что, скапливаясь в низинах, он вызывает удушье животных и даже людей. Известны несколько случаев в Африке, когда задыхались целые деревни.
- Горение и гниение органики. Горение и гниение — это одна и та же реакция окисления, но протекающая с разной скоростью. Богатые углеродом разлагающиеся органические остатки растений и животных, лесные пожары и тлеющие торфяники — все это источники диоксида углерода.
- Самым же большим природным хранилищем CO2 являются воды мирового океана, в которых он растворен.
Углекислый газ в природе
За миллионы лет эволюции основанной на углеродных соединениях жизни на Земле в различных источниках накопились многие миллиарды тонн углекислого газа. Его одномоментный выброс в атмосферу приведет к гибели всего живого на планете из-за невозможности дыхания. Хорошо, что вероятность такого одномоментного выброса стремится к нулю.
Лабораторные способы получения
Высококачественный СО2 — это результат брожения содержащих спирт жидкостей. Полученный таким способом газ обрабатывают реагентами, чтобы сформировать диоксид углерода в форме воды.
В лабораторных условиях извлекается незначительная часть СО2. В ходе реакций с участием гидрокарбонатов, кислот. Углекислота — побочный продукт реакций на производственных установках для извлечения кислорода, азота. СО2 хранят на предприятиях в баллонах, как и на складах. В них же вещество транспортируют.
Рекомендуем к прочтению:
- Какое давление в баллоне с углекислотой
- Сколько двуокиси углерода расходуется при сварке?
Искусственные источники углекислого газа
Углекислый газ попадает в атмосферу и в результате человеческой жизнедеятельности. Самыми активными источниками в наше время считаются:
- Индустриальные выбросы, происходящие в ходе сгорания топлива на электростанциях и в технологических установках
- Выхлопные газы двигателей внутреннего сгорания транспортных средств: автомобилей, поездов, самолетов и судов.
- Сельскохозяйственные отходы — гниение навоза в больших животноводческих комплексах
Кроме прямых выбросов, существует и косвенное воздействие человека на содержание CO2 в атмосфере. Это массовая вырубка лесов в тропической и субтропической зоне, прежде всего в бассейне Амазонки.
Искусственный источник углекислого газа
Несмотря на то, что в атмосфере Земли содержится менее процента диоксида углерода, он оказывает все возрастающее действие на климат и природные явления. Углекислый газ участвует в создании так называемого парникового эффекта путем поглощения теплового излучения планеты и удерживания этого тепла в атмосфере. Это ведет к постепенному, но весьма угрожающему повышению среднегодовой температуры планеты, таянию горных ледников и полярных ледяных шапок, росту уровня мирового океана, затоплению прибрежных регионов и ухудшению климата в далеких от моря странах.
Знаменательно, что на фоне общего потепления на планете происходит значительное перераспределение воздушных масс и морских течений, и в отдельных регионах среднегодовая температура не повышается, а понижается. Это дает козыри в руки критикам теории глобального потепления, обвиняющим ее сторонников в подтасовке фактов и манипуляции общественным мнением в угоду определенным политическим центрам влияния и финансово-экономическим интересам
Человечество пытается взять под контроль содержание углекислого газа в воздухе, были подписаны Киотский и Парижский протоколы, накладывающие на национальные экономики определенные обязательства. Кроме того, многие ведущие автопроизводители автомобилей объявили о сворачивании к 2020-25 годам выпуска моделей с двигателями внутреннего сгорания и переходе на гибриды и электромобили. Однако некоторые ведущие экономики мира, такие, как Китай и США, не торопятся выполнять старые и брать на себя новые обязательства, мотивируя это угрозой уровню жизни в своих странах.
Получение в промышленности
Получение диоксида углерода в промышленности методологически разнообразно. Он находится в дымовых отходах, выпускаемых в атмосферу ТЭЦ и электростанциями, получается при брожении спирта и выступает как продукт реакции с природными карбонатами.
Индустрия получения двуокиси углерода широка. Газ можно абсорбировать несколькими способами из одного источника. Во всех случаях это поэтапный процесс очистки от примесей (для достижения требований ГОСТа) и достижения нужной консистенции, агрегатного состояния.
Получение газообразной двуокиси углерода
Газообразный CO2 извлекают из промышленных (нефтяных) дымов путем адсорбции моноэтаноламина (коммерчески выгодно) и карбонатом калия (редко). Принцип сбора частиц углерода одинаков для обоих веществ. Они направляются по трубопроводу к отходам и собирают в себя углекислый газ. После сбора, насыщенные углекислотой газы направляются на очистку.
В специальных емкостях происходит реакция в при повышенной температуре или заниженном давлении. В процессе высвобождается чистая углекислота и продукты распада (аммиак и другие).
Установка добычи углекислоты
Схематически процесс выглядит так:
- Отходящий дым смешивается с адсорбентами (газообразным карбонатом калия или моноэтаноламином);
- Накопившие в себе двуокись углерода газы поступают в специальный газгольдер для очистки;
- В реакции с высокой температурой или низким давлением происходит отделение углекислого газа от адсорбента.
В лаборатории извлечь много CO2 не получается. Но это возможно в реакции с гидрокарбонатами и кислотами. В отдельности CO2 можно выделить на промышленных станках для получения кислорода, аргона или азота. Углекислый газ здесь выступает как побочный продукт. Хранится он в специальных баллонах, поставляемых потребителю.
Получение жидкой углекислоты
Добыча жидкой углекислоты поэтапно связана с получением ее из газа. Из летучего газообразного состояния, при обработке водородом, раствором перманганата калия и углем, образуется жидкая двуокись.
Сжижение происходит из-за низкого давления, сопровождающего реакцию. После многоступенчатой очистки, жидкий диоксид углерода попадает в компрессор. Там он сжимается и подается для сушки в 2 адсорбера, поочередно перенимающие работу для восстановления. Параллельно сжатая жидкость очищается от запахов и переводится в конденсатор, а оттуда – на хранение.
Этот метод сжижения применяется для газов спиртового брожения. Он актуален для пропана, бутана и т.д. Его используют на крупных пивоварнях, а получаемая очищенная углекислота имеет высокие показатели качества.
Получение твердого диоксида углерода
Твердый диоксид образуют из жидкого путем обработки низкой температурой (-56°). В промышленных условиях только 20% переходят в твердое состояние, а остальные – испаряются.
Сухой лед
Порядок извлечения углекислотных кристаллов (сухого льда):
- Из емкости брожения газ переходит в емкость для промывки;
- В газгольдере после мытья он сжимается и сжижается;
- Многократно сжимаясь и нагреваясь, газообразный углерод охлаждается в специальных холодильниках;
- Жидкость очищается активированным углем;
- Поступает в холодильник, где охлаждается и дополнительно очищается от примесей;
- Охлажденный CO2 направляется на испарение и пресс, где комплектуется сухой лед.
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов. Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом транспортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет. Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы. При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе. Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к смерти.
Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и транспортных средствах — везде, где в замкнутом пространстве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Применение
По ряду оценок, потребление СО2 на мировом рынке превышает 20 млн. метрических тонн в год. Столь высокий уровень потребления формируется под влиянием требований пищевой промышленности и нефтепромысловых предприятий, технологий газирования напитков и других промышленных нужд, например, снижения показателя Ph установок водоочистки, проблем металлургии (в том числе использования сварочного газа) и т.д.
Потребление углекислого газа неуклонно растет, поскольку расширяются сферы его применения, которые охватывают задачи от промышленного назначения до пищевого производства – консервация продуктов, в машиностроении от сварочного производства и приготовления защитных сварочных смесей до очистки поверхностей деталей гранулами «сухого льда», в сельском хозяйстве для подкормки растений, в газовой и нефтяной промышленности при пожаротушении.
Класс опасности и токсичности
Углекислый газ – это невзрывоопасное, негорючее, не поддерживающее горение вещество. В газообразной форме в 1,5 раза тяжелее воздуха, поэтому скапливается в шахтах, тоннелях, ямах, внутри подземного оборудования.
При контакте кожного покрова с углекислотой возможно покалывание пораженного участка, краснота, ощущение теплоты, вплоть до обморожения. Медленное согревание холодной водой приводит к прогрессированию болезни внешним источником холода.
Горячая вода может вызвать ожог пораженной области, в связи с частичной\полной потери температурной чувствительности дермы. Немедленно обратитесь к врачу!
Резервуары с газом СО₂ могут взрываться при воздействии высоких температур, ударах и сублимации сжиженной кислоты, разгерметизации баллона.
Напитки с углекислотой
Газирование напитков может происходить одним из двух путей:
- При производстве популярных сладких и минеральных вод используется механический способ газирования, который предполагает насыщение углекислым газом какой-либо жидкости. Для этого необходимо специальное оборудование (сифоны, акратофоры, сатураторы) и баллоны со сжатым углекислым газом.
- При химическом способе газирования углекислоту получают в процессе брожения. Таким образом получается шампанское вино, пиво, хлебный квас. Углекислота в содовых водах получается в результате реакции соды с кислотой, сопровождающейся бурным выделением углекислого газа.
СО 2 как сварочный газ
Начиная с 1960 года широкое распространение получила сварка легированных и углеродистых сталей в среде углекислого газа (СО 2 ), отвечающего требованиям ГОСТ 8050. В последнее время все большее распространение в сварочных технологиях машиностроительных предприятий находит применение сварочных газовых смесей аргона и гелия, при этом многие наиболее востребованные газовые смеси включают в себя небольшое количество активных газов (СО 2 или О 2 ), необходимых для стабилизации сварочной дуги. Однако при сварке углеродистых и низколегированных сталей основных структурных классов на российских предприятиях основным защитным газом по-прежнему продолжает оставаться углекислый газ СО 2 , что объясняется физическими свойствами этого защитного газа и его доступностью.