Что представляет собой раствор соляной кислоты? Это – соединение воды (H2O) и хлороводорода (HCl), который является бесцветным термическим газом с характерным запахом. Хлориды отлично растворяются и распадаются на ионы. Соляная кислота является самым известным соединением, которое образует HCl, так что о нем и его особенностях можно рассказать в подробностях.
Описание
Раствор соляной кислоты относится к классу сильных. Он бесцветный, прозрачный и едкий. Хотя техническая соляная кислота имеет желтоватый цвет, обусловленный наличием примесей хлора, железа и прочих элементов. На воздухе «дымится».
Стоит отметить, что данное вещество присутствует и в организме каждого человека. В желудке, если быть точнее, в концентрации 0.5%. Интересно, что этого количества достаточно для полного разрушения бритвенного лезвия. Вещество разъест его всего за неделю.
В отличие от той же серной, кстати, масса соляной кислоты в растворе не превышает 38 %. Можно сказать, что данный показатель – «критическая» точка. Если начать увеличивать концентрацию, то вещество просто будет испаряться, вследствие чего хлороводород просто улетучится вместе с водой. Плюс ко всему, данная концентрация сохраняется лишь при 20 °C. Чем выше температура – тем быстрее протекает испарение.
Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
- низкая температура кипения (t=48 градусов по Цельсию);
- высокая температура плавления (t=30 градусов по Цельсию);
- плотность составляет 1,18 г/см3;
- хлорид водорода обладает способностью к ионизации в водных растворах.
- при низкой температуре приобретает гидратную оболочку: HCL*H20 или HCl*2H2O;
- растворы хлороводородной кислоты бесцветные;
- в чистом виде находится в газообразном агрегатном состояние (а в растворах в жидкой форме);
- во влажном воздухе концентрированные растворы HCl могут сильно дымиться;
- соляная кислота – вещество, обладающее резким запахом.
Взаимодействие с металлами
Раствор соляной кислоты может вступать во многие реакции. В первую очередь с металлами, которые стоят до водорода в ряду электрохимических потенциалов. Это – последовательность, в которой элементы идут по мере увеличения такой свойственной им меры, как электрохимический потенциал (φ0). Данный показатель крайне важен в полуреакциях восстановления катиона. К тому же именно этот ряд демонстрирует активность металлов, проявляемую ими в окислительно-восстановительных реакциях.
Так вот, взаимодействие с ними происходит с выделением водорода в виде газа и с образованием соли. Вот пример реакции с натрием, мягким щелочным металлом: 2Na + 2HCl → 2NaCl +Н2↑.
С другими веществами взаимодействие протекает по похожим формулам. Так выглядит реакция с алюминием, легким металлом: 2Al + 6HCl → 2AlCl3 + 3Н2↑.
Как избавиться от засоров?
Для жесткой и целенаправленной очистки канализации от органических отложений (жиров, остатков еды, волос, моющих средств и пр.) следует использовать разбавленную соляную кислоту. Этот способ не подходит для стальных, железных и пластмассовых труб, так как соединение может привести к их коррозии и даже образованию сквозных дыр.
Перед началом проведения процедуры нужно закрыть сливные отверстия в другой сантехнике и обеспечить приток воздуха в помещение. Этот шаг необходим, так как в процессе работы кислота начнет активно вырабатывать токсичные газы.
Рекомендуется развести состав водой до достижения 3-10 % концентрации, после чего залить непосредственно в канализацию и оставить на 1-2 часа. Затем нужно промыть трубы большим количеством воды и при необходимости провести процедуру повторно.
Важный момент! Не следует смешивать реагент с другими средствами для прочистки канализации, особенно на основе щелочей. В противном случае реакция этих соединений приведет к сильному повреждению труб.
Реакции с оксидами
С данными веществами раствор кислоты соляной тоже прекрасно взаимодействует. Оксиды – это бинарные соединения элемента с кислородом, имеющие степень окисления, составляющую -2. Всем известными примерами являются песок, вода, ржавчина, красители, углекислый газ.
Соляная кислота взаимодействует не со всеми соединениями, а лишь с оксидами металлов. Вследствие реакции также образуется растворимая соль и вода. В качестве примера можно привести процесс, происходящий между кислотой и оксидом магния, щелочноземельного металла: MgO + 2HCl → MgCl2 + Н2О.
Чем опасно интоксикация
Соляная кислота представляет особую опасность для человеческого организма. При отравлении подобным веществом возможно развитие серьезных осложнений и нарушений функциональности организма.
Осложнения:
- Нарушение работы печени, как следствие токсический гепатит,
- Кровотечение в желудке из-за разрушенных стенок органа,
- Шоковое состояние от боли при попадании кислоты на территорию большой площади,
- При попадании в глаза нарушение зрительных функций,
- Серьезные сбои в работе почек,
- Нарушение дыхательного процесса, удушье, нехватка воздуха,
- Развитие коматозного состояния.
Подобные последствия развиваются постепенно в зависимости от степени отравления.
Реакции с гидроксидами
Так называются неорганические соединения, в составах которых присутствует гидроксильная группа –ОН, в которой атомы водорода и кислорода соединены ковалентной связью. И, поскольку раствор соляной кислоты взаимодействует лишь с гидроксидами металлов, стоит упомянуть, что некоторые из них называются щелочами.
Так что получающаяся в итоге реакция называется нейтрализацией. Ее результатом является образование слабо диссоциирующего вещества (то есть воды) и соли.
В качестве примера можно привести реакцию небольшого объема раствора соляной кислоты и гидроксида бария, мягкого щелочноземельного ковкого металла: Ва(ОН)2 + 2HCl = BaCl2 + 2Н2О.
Формула и другие названия соляной кислоты
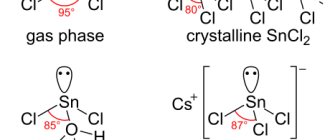
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Взаимодействие с другими веществами
Кроме перечисленного, соляная кислота может вступать в реакции и с соединениями иных типов. В частности, с:
- Солями металлов, которые образованы другими, более слабыми кислотами. Вот пример одной из таких реакций: Na2Co3 + 2HCl → 2NaCl +Н2О + СО2↑. Здесь показано взаимодействие с солью, образованной угольной кислотой (Н2СО3).
- Сильными окислителями. С диоксидом марганца, например. Или с перманганатом калия. Сопровождаются такие реакции выделением хлора. Вот один из примеров: 2KMnO4 +16HCl → 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2О.
- Аммиаком. Это – нитрид водорода с формулой NH3, представляющий собой бесцветный, но резко пахнущий газ. Следствие его реакции с раствором соляной кислоты – масса густого белого дыма, состоящего из мелких кристаллов хлорида аммония. Который, кстати, всем известен, как нашатырь (NH4Cl).Формула взаимодействия следующая: NH3 + HCl → NH4CL.
- Нитратом серебра – неорганическим соединением (AgNO3), являющимся солью азотной кислоты и металла серебра. Вследствие контакта с ним раствора соляной кислоты возникает качественная реакция – образование творожистого осадка хлорида серебра. Который не растворяется в азотной. Выглядит это так: HCL +AgNO3 → AgCl↓ + HNO3.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Получение вещества
Теперь можно поговорить о том, что делают для образования соляной кислоты.
Сначала, посредством сжигания в хлоре водорода, получают главный компонент – газообразный хлороводород. Который потом растворяют в воде. Результатом этой простой реакции становится образование синтетической кислоты.
Еще данное вещество можно получить из абгазов. Это – химические отходящие (побочные) газы. Они образуются при самых разных процессах. К примеру, при хлорировании углеводородов. Находящийся в их составе хлороводород называют абгазным. И кислоту, полученную таким образом, соответственно.
Следует отметить, что в последние годы доля абгазного вещества в общем объеме его производства увеличивается. А кислота, образованная вследствие сжигания в хлоре водорода, вытесняется. Однако справедливости ради нужно отметить, что в ней содержится меньше примесей.
Как происходит отравление
Соляная кислота – жидкое вещество без цвета, но с характерным резким запахом. Одна из самых сильных кислот, способна растворять некоторые металлы. Легко превращается в газ.
Хлористый водород используется в текстильной промышленности, кожевенном деле, металлургии драгметаллов, при производстве клея, кислот.
Вещество присутствует в желудке в минимальной концентрации. Кислота способствует нормализации пищеварительного процесса, защищает организм от вредных бактерий и микроорганизмов.
При концентрации, превышающей показатель в 24 %, соляная кислота способна нанести необратимый вред человеческому организму. Пары, образующиеся при контакте с воздухом, вызывают раздражение органов зрительной и дыхательной системы. Выделяют несколько факторов, способных спровоцировать развитие отравления.
Факторы:
Интоксикация парами возможна при работе в помещениях с плохой вентиляцией, Употребление внутрь по неосторожности, чаще происходит у детей, Попадание соляной кислоты на эпидермис, слизистую оболочку при несоблюдении правил использования реагента.
Отравление веществом в домашних условиях у взрослых людей происходит в результате применения без средств защиты кожного покрова, глаз, органов дыхательной системы. Интоксикация способна произойти при неаккуратном переливании кислоты из одной емкости в другую.
Применение в быту
Во многих чистящих средствах, которыми люди, занимающиеся хозяйством, пользуются регулярно, присутствует определенная доля раствора соляной кислоты. 2-3 процента, а иногда и меньше, но он там есть. Именно поэтому, приводя сантехнику в порядок (вымывая кафель, например), нужно надевать перчатки. Высококислотные средства могут навредить коже.
Еще раствор используют в качестве пятновыводителя. Он помогает избавиться от чернил или ржавчины на одежде. Но чтобы эффект был заметен, надо использовать более концентрированное вещество. Подойдет раствор соляной кислоты в 10%. Он, к слову, превосходно выводит накипь.
Важно правильно хранить вещество. Содержать кислоту в стеклянных емкостях и в местах, куда не доберутся животные и дети. Даже слабый раствор, попавший на кожу или слизистую оболочку, может стать причиной химического ожога. Если это случилось, необходимо срочно промыть участки водой.
Использование на производстве
Она имеет широкое применение в металлургической, пищевой и медицинской промышленности.
- Металлургии. Применение при паянии, лужении и зачистке металлов.
- Пищевая промышленность. Применение при производстве пищевых регуляторов кислотности, к примеру, Е507.
- Гальванопластика. Используется при травлении.
- Медицине. Находит свое применение при производстве искусственного желудочного сока.
Входит в состав синтетических красителей. Используется при производстве чистящих и моющих средств. Но в жидкостях, предназначенных для бытового использования, концентрация серной кислоты незначительна.
В области строительства
Использование соляной кислоты и ее растворов – это популярный способ улучшения множества строительных процессов. Например, ее нередко добавляют в бетонную смесь, чтобы увеличить морозостойкость. К тому же так она быстрее застывает, а стойкость кладки к влаге повышается.
Еще соляную кислоту используют, как очиститель от известняка. Ее 10-процентный раствор – лучший способ борьбы с грязью и следами на красном кирпиче. Для очистки других не рекомендуется его использовать. Структура других кирпичей более чувствительна к воздействию данного вещества.
Фармакодинамика и фармакокинетика
Что такое кислотность желудочного сока? Это характеристика концентрации Соляной Кислоты в желудке. Кислотность выражается в рН
. В норме в составе желудочного сока должна вырабатываться кислота и принимать активное участие в процессах пищеварения. Формула хлороводородной кислоты:
HCl
. Ее продуцируют париетальные клетки, расположенные в фундальных железах, с участием
Н+/К+-АТФазы
. Эти клетки выстилают дно и тело желудка. Кислотность желудочного сока сама по себе изменчива и зависит от числа париетальых клеток и интенсивности процессов нейтрализации вещества щелочными компонентами желудочного сока. Концентрация продуцируемой к-ты стабильна и равняется 160 ммоль/л. У здорового человека в норме должно вырабатываться не более 7 и не менее 5 ммоль вещества в час.
При недостаточной или избыточной выработке Соляной Кислоты возникают заболевания пищеварительного тракта, ухудшается способность усваивать некоторые и микроэлементы, например, железо. Средство стимулирует выделение желудочного сока, снижает рН
. Активирует
пепсиноген
, переводит его в активный фермент
пепсин
. Вещество благоприятно воздействует на кислотный рефлекс желудка, замедляет переход не до конца переваренной пищи в кишечник. Замедляются процессы брожения содержимого пищеварительного тракта, исчезает боль, и отрыжка, лучше усваивается железо.
После приема внутрь средство частично метаболизируется слюной и желудочной слизью, содержимым 12-перстной кишки. Несвязанное вещество проникает в 12-перстную кишку, где полностью нейтрализуется ее щелочным содержимым.
В медицине
В данной сфере рассматриваемой вещество тоже активно применяется. Разбавленная соляная кислота оказывает следующие действия:
- Переваривает в желудке белки.
- Останавливает развитие злокачественных образований.
- Помогает в лечении онкологических заболеваний.
- Нормализует кислотно-щелочной баланс.
- Служит эффектным средством при профилактике гепатита, сахарного диабета, псориаза, экземы, ревматоидного артрита, желчнокаменной болезни, розовых угрей, астмы, крапивницы и многих других недугов.
В общем, полезный препарат. Если у человека понижена кислотность желудочного сока, то ему не помешает пропить курс медикаментов, в составе которых есть соляная кислота. Неплохим вариантом является «Орто Таурин Эрго». Он увеличивает уровень соляной кислоты в желудочной среде, помогает бороться с бактериями и паразитами.
В голову пришла идея разбавить кислоту и употреблять ее внутрь в таком виде, а не в составе медикаментов? Такое практикуется, но категорически запрещено делать это без врачебной консультации и получения инструкции. Неправильно рассчитав пропорции, можно проглотить избыток раствора соляной кислоты, и просто сжечь себе желудок.
Кстати, еще можно принимать медикаменты, стимулирующие выработку данного вещества. И не только химические. Тот же аир, перечная мята и полынь способствуют этому. Отвары на их основе можно сделать самому, и пропить для профилактики.
Как и для чего применяют
Пожалуй, это по праву одно из важных веществ, которое встречается и необходимо практически во всех отраслях жизнедеятельности человека.
Локализация области применения:
- Металлургия. Очистка поверхностей от окисленных участков, растворение ржавчины, обработка перед спайкой, лужением. Соляная кислотапомогает извлекать мелкие вкрапления металлов из руд. Цирконий и титан получают, используя способ переведения оксидов в хлориды.
- Промышленность пищевых технологий. Раствор с низкой концентрацией применяется в качестве пищевой добавки. Желатин, фруктоза для диабетиков содержат в своем составе чистый эмульгатор. Обычная сода так же обладает высоким коэффициентом содержания данного вещества. На упаковке товаров увидите его под названием Е507.
- Область медицины. При недостаточном показателе кислотной среды в желудке и проблемах с кишечником. Низкий уровень Ph приводит к появлению рака. Даже при надлежащем питании, витаминов в достатке, опасность не исчезает, необходимо проводить анализы для получения сока из желудочного тракта, ведь при недостаточно кислой среде полезные вещества практически не всасываются, нарушается пищеварение.
- Раствор соли используется как ингибитор – защита от грязи и инфекций, антисептическое действие. Для изготовления клеевых смесей, изделий из керамики. Ним промывают теплообменники.
- Процедура очистки воды для питья тоже не обходится без участия хлора.
- Изготовление каучука, отбеливание тканевых основ.
- Можно ухаживать за линзами с помощью данного раствора.
- Полоскание полости рта в домашних условиях
- Вещество отлично проводит электрический ток.
Ожоги и отравление
Каким бы эффективным ни было это средство, оно опасно. Соляная кислота, в зависимости от концентрации, может спровоцировать химические ожоги четырех степеней:
- Возникает лишь покраснение и боль.
- Появляются пузыри с прозрачной жидкостью и отек.
- Формируется некроз верхних слоев кожи. Пузыри заполняются кровью или мутным содержимым.
- Поражение достигает сухожилий и мышц.
Если вещество каким-то образом попало в глаза, надо промыть их водой, а потом содовым раствором. Но в любом случае первым делом надо вызвать скорую.
Попадание кислоты внутрь чревато острыми болями в груди и животе, отеком гортани, рвотными кровавыми массами. Как следствие – тяжелые патологии печени и почек.
А к первым признакам отравления парами относят сухой частый кашель, удушье, повреждение зубов, жжение в слизистых оболочках и боли в животе. Первая неотложная помощь – это умывание и полоскание полости рта водой, а также доступ к свежему воздуху. Настоящую помощь может оказать лишь токсиколог.
Первая помощь и методы лечения
При обнаружении признаков отравления требуется вызвать бригаду скорой помощи. В домашних условиях допускается проводить мероприятия, направленные на улучшение состояния пострадавшего. Первая помощь при отравлении соляной кислотой должна проводиться быстро, чтобы уменьшить риск возникновения негативных последствий.
Мероприятия:
- При попадании соляного соединения на кожные покровы места повреждения промывают большим количеством прохладной воды. Длительность обработки составляет не менее получаса.
- При интоксикации парами пострадавшему обеспечивают доступ свежего воздуха, открывают окна, расстегивают тесную одежду.
- Рекомендуется следить за состоянием пациента, при отсутствии признаков жизни проводятся реанимационные действия.
- Пострадавшему от паров разрешается дать выпить теплый чай, воду. Рекомендуется провести полоскание полости носа и рта прохладной водой.
- При передозировке, возникнувшей в результате употребления кислоты внутрь, на живот кладут пузырь со льдом, чтобы исключить либо уменьшить возможное кровотечение.
- Не допускается употребление каких-либо лекарственных средств. Разрешается дать пациенту стакан воды (можно минеральной щелочной). Употреблять жидкость требуется маленькими глотками.
- Не разрешено промывать желудок, пытаться вызвать рвотные позывы в домашних условиях. Подобная первая помощь способна привести к развитию ожогов горла, кровотечению.
Лечение проводится в медицинском учреждении под контролем специалистов.
Терапия:
- Очищение желудка при помощи зонда,
- Использование капельниц с лекарственными растворами,
- Назначение препаратов, снимающих болезненные ощущения,
- Применение медикаментов, направленных на восстановление работы органов и систем,
- При необходимости ингаляции кислородом и искусственная вентиляция легких,
- Проведение реанимационной терапии при отсутствии признаков жизни,
- Подбор витаминов и специального питания.
Лечение проводится в реанимации, а затем в стационаре. Длительность зависит от состояния пациента и степени отравления.
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH-(р-р) Kc = [H3O+][OH-]/[H2O]2 Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее равенство: [H3O+][OH-] = 10-14, что называется константой диссоциации воды. Для чистой воды [H3O+] = [OH-] = 10-7, откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Хранение и транспортировка
Хранят и транспортируют соляную техническую кислоту в специализированных покрытых полимерами цистернах и контейнерах, бочках из полиэтилена, стеклянных бутылях, упаковываемых в ящики. Люки контейнеров и цистерн, пробки бочек и бутылей должны обеспечивать герметичность емкости. Кислотный раствор не должен контактировать с металлами, находящимися в линейке напряжения левее водорода, так как это может стать причиной возникновения взрывоопасных смесей.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
История открытия
Трудно сказать, кто и когда впервые получил соляную кислоту. Известно, что уже в конце XV в. алхимик Василий Валентин и в XVI в. Андреас Либаве в исполнительных поисках чудодейственного жизненного эликсира прокаливали в своих алхимических приборах поваренную соль с квасцами и купороса и получили продукт, который описали под названием «кислого спирта». Это и была знакома теперь нам соляная кислота, очень нечисто.
Для первых исследователей это была совершенно новая вещество, обладавшей свойствами, которые сильно поражали их воображение. Нюхая ее, они задыхались и кашляли, «кислый спирт» дымов в воздухе. При пробе на вкус, она обжигала язык и небо, металлы она разъедала, ткани разрушала.
В 1658 г.. Немецкий химик И. Глаубер (1604-1670) нашел новый способ получения соляной кислоты, которую он назвал «соляным спиртом». Способ этот широко применяется до сих пор в лабораториях. Он нагревал поваренную соль с концентрированной серной кислотой и «дым», который выделялся, поглощал водой.
В 1772 г.. Английский химик Джозеф Пристли (1733-1804) установил, что при действии серной кислоты на поваренную соль выделяется бесцветный газ, который может быть собран над ртутью, и этот газ имеет очень большую способность растворяться в воде. Водный раствор этого газа получил название «соляной кислоты» (acidum muriaticum), а сам газ Пристли назвал «чистой газообразной соляной кислотой».
В 1774 шведский химик К.В. Шееле (1742-1786), исследуя действие соляной кислоты (которую он называл еще «соляным спиртом») на оксид марганца (IV), нашел, что он растворяется в соляной кислоте на холоде, образуя темно-коричневый раствор, из которого при нагревании выделяется газ желто-зеленого цвета, обладающий очень резким запахом, способностью разрушать растительные краски и действует на все металлы, не исключая золота. Шееле, как последователь флогистонной теории, господствовавшей в то время, считал, что смысл этой реакции заключается в том, что под действием оксида марганца (IV) с соляной кислотой уходит из нее флогистон, благодаря чему соляная кислота превращается в желто-зеленый газ. Поэтому сам газ он назвал «дефлогистированный соляной кислотой».
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие — содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
| Бескислородные | Кислородсодержащие |
| HCl | HClO4 |
| H2S | H2SO3 |
| HBr | HBrO |
| HI | HIO2 |