Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Процесс сварки
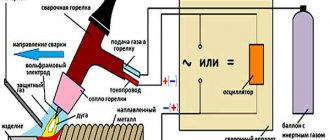
Применение ацетилена при сварке должно осуществляться аккуратно и в соответствии с определенными правилами. Для начала горелку следует продуть газом. Это нужно делать до тех пор, пока не появится запах ацетилена. После этого газ поджигается. При этом следует добавлять кислород, пока пламя не станет более устойчивым. Из редуктора на выходе давление ацетилена должно быть от 2 до 4 атмосфер, а кислорода – от 2 атмосфер.
Для сварки черных металлов требуется нейтральное пламя. Оно обладает четко очерченной короной и условно его можно разделить на три яркие части: ядро – ярко-голубой окрас с зеленоватым отливом, восстановленное пламя – бледно-голубого оттенка, факел пламени. Последние две зоны являются рабочими.
Перед началом работы все детали нужно очистить, а затем подогнать друг к другу. При работе с горелкой также применяют левый и правый способ. В последнем случае происходит медленное остывание шва. Присадочный материал, как правило, перемещается за горелкой. При левом способе повышается эластичность и прочность шва. В данном случае пламя направляется от места сварки. Присадочный материал следует вносить в сварочную ванну только после того, как переместится на следующую позицию горелка.
Реакции ацетилена
Ацетилен вступает в реакцию с различными соединениями, например, солями меди и серебра. В результате таких взаимодействий получают вещества под названием ацетилениды. Их отличительная черта — взрывоопасность.
Получение ацетилена
Горение ацетилена
Реакция окисления ацетилена
Реакция полимеризации
Реакция замещения ацетилена
Структурная изомерия
Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.Например. Изомеры с различным углеродным скелетом и с формулой С4Н6 — бутин-1 и бутадиен-1,3
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкины являются межклассовыми изомерами с алкадиенами. Общая формула алкинов и алкадиенов — CnH2n-2.
Хранение и транспортировка ацетилена
Ацетилен выпускают по ГОСТ 5457 растворенным и газообразным. Хранят и транспортируют его в растворенном состоянии в специальных стальных баллонах по ГОСТ 949, заполненных пористой, пропитанной ацетоном массой. Ацетилен, растворенный в ацетоне не склонен к взрывчатому распаду.
Баллоны окрашены в серый цвет и надписью красными буквами «АЦЕТИЛЕН» на верхней цилиндрической части.
Максимальное давление ацетилена при заполнении баллона составляет 2,5 МПа (25 кгс/см2), при отстое и охлаждении баллона до 20°С оно снижается до 1,9 МПа (19 кгс/см2). При этом давлении в 40-литровый баллон вмещается 5-5,8 кг С2Н2 по массе (4,6-5,3 м3 газа при 20°С и 760 мм рт. ст.).
Давление ацетилена в полностью наполненном баллоне изменяется при изменении температуры следующим образом:
| Температура, °С | -5 | 5 | 10 | 15 | 20 | 30 | 40 | |
| Давление, МПа | 1,3 | 1,4 | 14 | 1,7 | 1,8 | 12 | 2,4 | 3,0 |
Другие требования техники безопасности можно узнать из статьи о классе опасности и мерах безопасности при работе с ацетиленом
Сварочные работы с использованием ацетилена
Традиционно этот газ применяют при проведении процедуры по автогенной сварке, а также резке металлов. Технология подразумевает использованием двух баллонов с газом, в одном из которых находится кислород, а в другом — ацетилен. Вещества поступают в специализированную горелку, и при сгорании образуется очень горячее пламя. Его температура может достигать 3200 градусов по Цельсию. Самым «эффективным» считается сочетание газов, при котором в смеси содержится 45% ацетилена. При таких условиях удается оперативно расплавить даже достаточно толстые куски листовой стали.
Применение алкинов (ацетиленовых углеводородов) в медицине
Ацетилен
– один из базовых сырьевых источников промышленности органического синтеза. При конденсации ацетилена с пирролидоном получают N-винилпирролидона, который легко полимеризуется с синтезом Полимерные соединения на основе винилпирролидона нашли широкое применение в медицинской практике как вещества при производстве лекарственных препаратов, а многие из них сами являются лекарственными. Например низкомолекулярный поливинилпирролидон (12000-13000 молекулярная масса) образует коллоидные растворы в воде и используется в процессе приготовления гемодеза (кровезаменителя), среднемолекулярные поливинилпирролидон (с молекулярной массой 35000-40000) применяется в фармации как связующее вещество для изготовления таблеток.
Применение
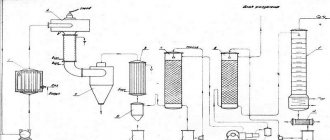
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
2CH4→ СH≡CH +3H2.
В лаборатории ацетилен получают гидролизом карбида кальция:
CaC2 +2H2O = Ca(OH)2 + C2H2.
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
CH3-CH3→ СH≡CH +2H2;
CH2=CH2→ СH≡CH +H2.
Использование в промышленности и быту
Впрочем, автогенная сварка и резка металлов — не единственная сфера применения. Достаточно часто ацетилен используют в качестве источника яркого белого света в автономных приборах освещения. В данном случае его получают с помощью реакции воды и карбида кальция.
Такие лампы были крайне востребованы в прошлом столетии, ими освещали кареты и автомобили. Но и сегодня карбидные устройства, то есть созданные с использованием ацетилена, применяют при благоустройстве отдаленных маяков. Ключевое преимущество карбидных ламп — экономичность и отсутствие необходимости в подключении к электросети. Соответственно, при их установке на маяке не возникает необходимости в подведении линии электропередач, то есть оплате дорогостоящей услуги. Также лампы востребованы на судах дальнего плавания.
Ацетилен используют в промышленности. Его применяют при получении различных продуктов органического синтеза. Например, его используют для создания:
- уксусной кислоты;
- синтетического каучука;
- растворителей;
- некоторых видов пластмасс.
Следует отметить, что ацетилен нашел применение и в медицине, например, его иногда используют при ингаляционном наркозе.
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который практически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород, состоящий из двух атомов углерода и двух атомов водорода.
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен имеет тройную связь между атомами углерода.
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород, сероводород и пр., которые придают ему резкий запах.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ. Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде. Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Что делать, если возник пожар
Неправильное применение ацетилена может привести к печальным последствиям. Этот газ взрывается и приносит сильное разрушение. Что же делать, если возник пожар?
При возникновении пожара следует незамедлительно убрать из опасной зоны все емкости, наполненные ацетиленом. Те баллоны, которые остались, следует постоянно охлаждать обычной водой или же специальным составом. Емкости должны полностью остыть.
Если воспламенился газ, который выходит из баллона, то следует незамедлительно закрыть емкость. Для этого следует использовать неискрящийся ключ. После этого емкость необходимо остудить.
При сильном возгорании тушение огня следует осуществлять только с безопасного расстояния. В такой ситуации стоит использовать огнетушители, наполненные составом, содержащим флегматизирующую концентрацию азота 70 % по объему, также диоксид углерода 75 % по объему, песок, струи воды, сжатый азот, полотно асбестовое и так далее.