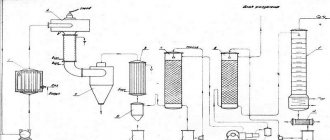
Карбидный способ
Можно из метана получить ацетилен или в качестве исходного вещества взять карбид кальция. Процесс протекает при обычных условиях. При взаимодействии карбида кальция с водой образуется не только ацетилен, но и гидроксид кальция (гашеная известь). Признаками протекания химического процесса будет выделение газа (шипение), а также изменение окраски раствора при добавлении фенолфталеина на малиновый цвет.
При применении в качестве исходного вещества технического карбида, имеющего различные примеси, в процессе взаимодействия наблюдается неприятный запах. Он объясняется присутствием в продуктах реакции таких ядовитых газообразных веществ, как фосфин, сероводород.
Применение ацетилена
Ацетилен применяется при всех процессах газопламенной обработки металлов (газовой сварке и газовой резки), благодаря высокой температуре пламени, достигнуть которой при использовании других горючих не удается.
Для пайки, резки, наплавки, газопламенной закалки, металлизации, газопрессовой сварки, сварки цветных металлов и сплавов с успехом применяются газы-заменители ацетилена:
- пропано-бутановые смеси
- городской газ
- природные газы
- водород
- пары бензина
- пары керосина
- МАФ
- и др.
По химическому составу все они, за исключением водорода, представляют собой или соединения, или смеси различных углеводородов.
Правильный выбор и использование газов-заменителей позволяет добиться высокого качества сварки и резки, а при газовой резке металлов малых толщин дает более высокую чистоту резки.
Газовая сварка возможна при условии, что температура пламени в два раза превышает температуру плавления свариваемого металла. Поэтому газы-заменители температура пламени которых ниже, чем у ацетилена применяют для сварки металлов с температурой плавления ниже, чем у сталей
Для газовой резки выбор горючего газа основывается на его теплотворной способности, но необходимо учитывать, что газ при сгорании в смеси с кислородом должен образовывать пламя с температурой не ниже 2000°C.
Влияние примесей в ацетилене на качество сварного шва
Давайте остановимся еще на некоторых особенностях применения ацетилена при газовой сварке – влияние примесей на качество сварного шва. Вредное влияние имеют следующие примеси:
- сероводород
- фосфористый водород
Вышеуказанные примеси обязательно удаляются из ацетилена, не только из-за влияния на качество сварного шва, но также из-за пагубного влияния на органы дыхания и зрения сварщика (см. статью Взрывоопасность, ядовитость и самовоспламенение ацетилена).
Сероводород при сгорании образовывает серную кислоту, которая при переходе в металл сварного шва вызывает красноломкость. Установлено, что наличие сероводорода до 0,007% не оказывает вредного влияния на прочность сварного шва.
Определить наличие сероводорода в ацетилене довольно легко, необходимо поднести фильтровальную бумагу, смоченную в растворе хлористой ртути под струю ацетилена. При наличии сероводорода — бумага побелеет.
Процесс очистки от сероводорода тоже довольно простой – необходимо ацетилен пропустить через воду, в результате чего сероводород растворится в воде.
Фосфористый водород при сгорании образовывает фосфорную кислоту, которая при переходе в металл сварного шва вызывает хладноломкость. Установлено, что наличие фосфористого водорода до 0,027% не оказывает вредного влияния на прочность сварного шва.
Для определения наличия фосфористого водорода необходимо кусок фильтровальной бумаги, смоченный в десятипроцентном растворе азотнокислого серебра поднести под струю ацетилена. При содержании 0,01% фосфористого водорода бумага принимает отчетливую светло- желтую окраску, при содержании более 0,02% — бумага темнеет.
Химическим путем очистка ацетилена от фосфористого водорода производится путем пропускания через особую очистительную массу – гератоль. Гератоль представляет собой массу желтого цвета, которая в результате взаимодействия с фосфористым водородом приобретает зеленый цвет.
Применение ацетилена в химической отрасли
Помимо газопламенной обработки ацетилен используют в области химической промышленности в качестве основного исходного вещества для получения ряда важнейших продуктов органического синтеза: синтетического каучука, пластмасс, растворителей, уксусной кислоты и т. п. Далее мы рассмотрим, как ацетилен используется для получения тех или иных химических соединений.
Уксусный альдегид
Продуктом присоединения воды к ацетилену является уксусный альдегид. Впервые этот синтез был осуществлен М. Г. Кучеровым в 1881 г. Реакция протекает по уравнению:
HC = CH + H2O ? CH3 — CHО
Реакция проводится пропусканием ацетилена через сернокислый раствор соли окиси ртути при температуре 70-80°C.
Применение этой реакции явилось началом промышленного синтеза органических веществ с применением ацетилена в качестве исходного продукта.
Ацетон
При пропускании смеси ацетилена и паров воды в соотношении примерно 1:10 при температуре 430-450°C над цинк-ванадиевым катализатором происходит образование ацетона по уравнению:
2C2H2 + 3H2O ? CH3-CО-CH3 + CО2 + H2О
Указанный процесс нашел применение в промышленных масштабах.
Хлористый винил
При взаимодействии ацетилена с хлористым водородом при 200°C над катализатором, представляющим собой двухлористую ртуть, нанесенную на активированный уголь, образуется хлористый винил по уравнению:
C2H2 + HCl ? CH2 = CHCl
Винилацетат
C уксусной кислотой также в присутствии ртутных солей ацетилен образует винилацетат:
C2H3 + CH3COOH ? CH2 = CH-ОCО-CH3
Хлористый винил и винилацетат широко применяются при производстве пластмасс.
Крекинг нефтепродуктов
Автомобильный осциллограф: понятие и принципы работы
В настоящее время можно не только из метана получить ацетилен. Основным промышленным методом производства этого представителя алкинов считается крекинг (расщепление) углеводородов. Если из метана получить ацетилен, то энергетические затраты будут минимальными. Помимо недорогого и доступного сырья, такая технология привлекает производителей углеводородного сырья простотой технологического оборудования, применяемого в процессе дегидрирования метана.
Существует два варианта проведения подобного химического процесса. Первый способ базируется на пропускании метана через электроды, раскаленные до 1600 градусов по Цельсию. Технология предполагает резкое охлаждение полученного продукта. Второй вариант дегидрирования метана с получением ацетилена предполагает применение энергии, которая образуется при частичном горении этого алкина.
Баллоны, в которых содержится ацетилен, не могут комплектоваться бронзовыми вентилями, так как в составе бронзы содержится медь. Взаимодействие данного металла с ацетиленом сопровождается получением взрывоопасной соли.
Как синтезировался ацетилен
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина AsH3.
Метод получения ацетилена из метана
Метан является одним из наиболее доступных и дешевых видов сырья для органического синтеза. Полученные из него вещества отличаются доступной ценой. Получение ацетилена из метана (электрокрекинг) происходит при температуре около 1600 градусов. Между двух электродов пропускают поток метана, который разлагается на ацетилен и водород. Главная задача – быстро охладить взрывоопасный газ и наполнить им баллоны белого цвета. В них ацетилен поступает на строительные площадки и в цеха промышленных предприятий. Здесь его используют вместе с кислородом: смешивание этих газов позволяет получить пламя с высокой температурой, применяемое для сварки и резки металлов.
Получение ацетилена пиролизным способом
Пиролизный ацетилен получают путем сжигания метана в смеси с кислородом в реакторах при температуре 1300-1500°C. В результате чего получается смесь, которая содержит:
- ацетилен — до 8%;
- водород — 54%;
- окись углерода — 25%;
- примеси – до 13%.
При помощи растворителя (диметилформамида) из нее извлекается ацетилен концентрации 99,0-99,2%. Оставшаяся часть пиролизных газов используется для производства аммиака и других продуктов.
Также ацетилен получают путем разложения жидких горючих (нефть, керосин) действием электродугового разряда, который называется электропиролизом.
Пиролизный и электропиролизный ацетилена по своим свойствам является идентичным ацетилену, получаемому из карбида кальция, но дешевле на 30-40%.
Анализ радикальной реакции плазменного пиролиза метана»
Автор — tokarna***@rambler.ru
СОДЕРЖАНИЕ
ВВЕДЕНИЕ…………………………………………………………………3
1 Способы получения ацетилена из метана………………………………4
1.1 Физико-химические свойства веществ – участников реакции………5
2 Механизм образования водородной плазмы……………………………7
3 Механизм реакции пиролиза метана в струе водородной плазмы…….7
4 Изучение зависимости изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени……………………………………………………………………………..9
ВЫВОДЫ………………………………………………………………….12
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ……………………..13
ВВЕДЕНИЕ
Современную химическую технологию отличает стремление к использованию все более высоких режимных параметров (температуры, давления, скоростей потоков реагирующих веществ), позволяющих изменить в желаемом направлении прохождения химических реакций. Широкие перспективы в этом отношении открывает использование низкотемпературной плазмы.
Пиролиз углеродсодержащих соединений в плазме восстановительных и инертных газов привлекателен с точки зрения возможности получения непредельных соединений и в первую очередь – ацетилена, а также возможности плазменного производства высококачественной сажи.
Почти вытесненный в 60-е годы прошлого века этиленом и пропиленом ацетилен как химическое сырье все же не утратил своего значения в органическом синтезе в связи с изменением структуры топливного баланса. В настоящее время внимание к ацетилену вновь повысилось. Ацетилен является исходным продуктом в производстве винилацетата, винилхлорида, акрилонитрила и других мономеров с последующим их превращением в полимеры. Наиболее заметно увеличение потребления ацетилена для синтеза 1,4-бутандиола. Кроме того, ацетилен достаточно широко используется в сварочных работах (так называемый «баллонный» ацетилен).
Целью данной работы является анализ реакции пиролиза метана в потоке низкотемпературной плазмы.
Основными задачами анализа являются изучение свойств всех участников реакции, анализ механизма радикальной реакции и изучение зависимости изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени.
1 Способы получения ацетилена из метана
Наиболее распространенным способом производства ацетилена является окислительный пиролиз природного газа или нафты (низкооктанового бензина) при температурах 1600-1800 К за счет экзотермических реакций окисления углеводородов кислородом. Этот процесс значительно вытесняет громоздкий, экологически вредный и энергоемкий карбидный метод. Однако сравнение окислительного пиролиза с плазмохимическим пиролизом по основным показателям демонстрирует преимущества последнего (таблица 1).
Таблица 1 — Сравнение окислительного пиролиза с плазмохимическим пиролизом по основным показателям
| Показатели | Окислительный пиролиз | Плазмохимический пиролиз |
| Расход СН4 (т) на 1 т С2Н2 | 7,5 — 8 | 1,7 |
| Селективность СН4 в С2Н2, % | 30 | 65 — 85 |
| Концентрация С2Н2 в газе пиролиза, % об. | 10 | 12 — 25 |
| Энергоемкость, т.у.т.* 1 т С2Н2 | 11,8 | 6,3 |
*т.у.т. – тонны условного топлива
Как видно из таблицы 1, концентрация ацетилена в продуктах окислительного пиролиза в два раза меньше, чем в плазмохимическом, расход сырья на 1 т ацетилена практически в 2,5 — 3 раза больше в окислительном методе по сравнению с плазмохимическим, энергоемкость (затраты всех видов ресурсов, выраженные в т.у.т.) плазмохимического способа почти в два раза ( 80%) ниже окислительного, себестоимость ацетилена, полученного плазмохимическим способом, по сравнению с окислительным ниже на 40%. К тому же плазмохимический метод получения ацетилена не требует строительства кислородного завода, который необходим для окислительного метода.
При выборе того или иного метода получения ацетилена необходимо провести оценку сырьевой базы, сопутствующих производств, специфики региона.
Сырьем в окислительном производстве являются: 1) углеводороды; 2) кислород; 3) водяной пар. Побочные продукты этого процесса — синтез-газ и азот, требуют своего потребителя.
Для плазмохимического способа необходима потребность: 1) в сырьевой базе — углеродсодержащие вещества различного происхождения и электроэнергия; 2) в потребителе побочной продукции — водорода и сажи.
Производство этилена в настоящее время также столкнулось с рядом проблем при традиционных способах его получения в трубчатых печах. Сырьем в этих процессах являются легкие фракции продуктов нефтепереработки. Однако в связи с изменением структуры потребления нефтепродуктов и повышенным спросом на моторное топливо основным сырьем для производства этилена становятся мазут и другие тяжелые фракции, использование которых в традиционных технологиях весьма затруднительно ввиду значительного выхода смол и углерода. Это также стимулирует внедрение плазмохимических методов пиролиза.
Нетребовательность к сырью — одно из достоинств плазмохимических процессов — дает дополнительное преимущество этому методу. В качестве сырья в плазмохимическом пиролизе с целью получения ацетилена использовался широкий спектр углеродсодержащих материалов, начиная с метана и заканчивая углем.
1.1 Физико-химические свойства веществ – участников реакции
Основные физико-химические свойства веществ – участников реакции приведены в таблице 2.
Таблица 2 — Физико-химические свойства веществ – участников реакции [3]
| Вещество | Температура плавления, ℃ | Температура кипения, ℃ | Применение | Токсическое действие |
| 1 | 2 | 3 | 4 | 5 |
| СН4 (метан) | -182,5 | -161,58 | В качестве топлива, для получения водяного газа, водорода, ацетилена, в производстве сажи, хлористого метила, синильной кислоты. | Первые признаки асфиксии (учащение пульса, увеличение объема дыхания и т. д.) начинает обнаруживаться, когда содержание кислорода в воздухе падает на 25-30 %; смесь из 80% метана и 20% кислорода вызывает головную боль. Класс опасности – 4. |
| НС СН (ацетилен) | -80,0 | 83,8 | Для автогенной сварки, для осветительных целей; как исходный продукт для получения уксусного альдегида, виниловых эфиров, хлористого винила, тетрахлорэтана, нитрила акриловой кислоты и т. д. | Сильное возбуждение, сменяющееся коматозным состоянием, синюхой, неподвижностью зрачков, слабым и неправильным пульсом. Класс опасности – 4. |
| Н2С=СН2 (этилен) | -169,2 | -103,7 | Сырье в производстве полиэтилена, окиси этилена, этилового спирта, этаноламинов, ПВХ, тиокола и др. | Запах ощущается при концентрации 0,02 – 0,026 мг/л. Быстрый наркоз без заметной стадии возбуждения наступает при 80 % этилена с О2. Класс опасности – 4. |
| Н3С-СН3 (этан) | -182,8 | -89 | Основное использование этана в промышленности — получение этилена. | Малотоксичен. Обладает наркотическим действием. Класс опасности – 4. |
| С (сажа) | — | 360 – 380 (температура воспламенения) | При производстве резин и типографской промышленности в качестве красителя. | Класс опасности – 4. |
| Н2 (водород) | -259,14 | -252,8 | Для синтеза аммиака, карбамида, метанола; при гидрогенизации жиров, нефтепродуктов, углей и смол; как восстановитель; для автогенной резки и сварки; для наполнения аэростатов, метеорологических шаров-зондов. | Физиологически инертный газ. Вызывает удушение в очень высоких концентрациях из-за уменьшения нормального давления кислорода. Наркотическое действие проявляется при очень высоких давлениях. Класс опасности – 2. |
Все вещества – участники реакции не относятся к высокотоксичным веществам и находят широкое применение как в химической, так и в нефтехимической отраслях.
2 Механизм образования водородной плазмы
В плазмотрон между двух электродов поступает газ – водород. Через электроды (один- графитовый, второй – ферритовый) проходит электрический ток. Под действием электрического тока по следующей схеме образуется молекулярный ион водорода и электрон:
Образовавшийся электрон переносится на поверхность металла.
Молекулярный ион водорода под воздействием электрического тока диссоциирует на ион водорода и атом водорода:
Затем происходит ионизация атома водорода:
Таким образом, образуется частично ионизированный газ, содержащий нейтральные атомы (молекулы) и заряженные частицы (ионы и электроны).
3 Механизм реакции пиролиза метана в струе водородной плазмы
Основным видом углеводородного сырья для получения ацетилена является природный газ – метан. Реакция проходит при 1500 — 1600 и при атмосферном давлении в струе водородной плазмы, которая является высокотемпературным теплоносителем.
Главной трудностью для получения ацетилена пиролизом природного газа является необходимость создания высоких температур и подвода больших количеств тепла на эндотермическую реакцию образования ацетилена из метана.
В общем виде реакция получения ацетилена из метана и ее мольный баланс в потоке плазмы имеет вид:
СН4 НС СН + Н2С=СН2 + Н3С-СН3 + С + СН4 + Н2 – 90
1 0,60 0,21 0,05 0,01 0,06 0,77
Температура плазменной струи в начале процесса очень быстро падает за счет передачи тепла введенному метану и протекания эндотермических реакций его разложения.
Образование ацетилена из метана проходит по механизму, предложенному Касселем. Активные атомы водорода, входящие в состав плазмы, отрывают водород у молекулы метана, образуя соответствующие радикалы:
От молекулы этилена легче оторвать водород, так как энергия связи С-С в молекуле этилена равна 101,16 , а энергия связи С-Н равна 85,56 .
Стадия обрыва цепи:
Термодинамическая устойчивость ацетилена при температурах выше 1100 К больше, чем других углеводородов. Однако при очень высоких температурах идут конкурентные реакции уплотнения и распада ацетилена [6, с.64].
НС СН С + Н2 + 54,9
В связи с этим пиролиз с целью получения ацетилена ведут при очень малых временах контакта с быстрой «закалкой» продуктов реакции.
4 Изучение зависимости изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени
Важной предпосылкой научной разработки плазмохимического процесса пиролиза метана является расчет кинетики этого процесса. На электронной вычислительной машине была численно проинтегрирована система уравнений гидродинамики и химической кинетики высокотемпературной газовой струи, в которой происходит разложение метана и «закалка» ацетилена. Уравнения химической кинетики были записаны исходя из предположения образования ацетилена из метана по известной схеме Касселя. Результаты решения этой системы уравнений приведены на рисунках 1, 2, 3. [1, с.283].
Рисунок 1 – Зависимость изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени
Как видно из рисунка 1, на первых стадиях реакции происходит быстрое понижение температуры. Такое понижение температуры объясняется протеканием в основном эндотермической реакции разложения метана, идущей при начальной температуре реакции с весьма высокой скоростью.
Рисунок 2 – Зависимость изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени
Как видно из рисунка 2, с понижением температуры скорость разложения метана резко падает, происходит самопроизвольное торможение реакции, которое может быть названо автозакалкой, в отличие от принудительной закалки, осуществляемой путем специальных внешних воздействий.
Рисунок 3 – Зависимость изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени
Как видно из рисунка 3, на дальнейших стадиях реакции происходит разложение ацетилена до сажи и водорода, сопровождающееся выделением тепла и повышением температуры. Для устранения нежелательного разложения ацетилена необходимо провести принудительную закалку. Место, время и скорость принудительной закалки определяются кинетикой рассматриваемых процессов. Кинетический расчет позволил оценить величину скорости принудительного понижения температуры, необходимую для сохранения образовавшегося ацетилена. Она составляет ~ 106 град/сек.
Поскольку промышленный интерес может представлять пиролиз метана в плазменной струе водорода, в лабораторной установке в качестве плазмообразующего газа также был применен водород. Выбор водорода в качестве плазмообразующего вещества обусловлен прежде всего тем, что водород является одним из основных продуктов реакции, объемный выход которого в три раза превышает объемный выход ацетилена. Следовательно, в условиях промышленного производства процесс пиролиза метана в водородной плазменной струе оказывается с избытком обеспеченным водородом в качестве рабочего тела для плазмотрона. Кроме того, при температуре около 4500-5000 К водород, почти полностью диссоциированный на атомы, является эффективным теплоносителем и реагентом. Он также препятствует образованию сажи и, кроме того, оказывает существенное влияние на химию процесса.
ВЫВОДЫ
- Изучена реакция плазменного пиролиза метана, целевым продуктом которой является ацетилен. Однако при температурах выше 1100 К идут конкурентные реакции уплотнения и распада ацетилена, в связи с чем пиролиз ведут с быстрой «закалкой» продуктов реакции.
- Изучена зависимость изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени и установлено, что температура плазменной струи в начале процесса очень быстро падает за счет передачи тепла введенному метану и протекания эндотермических реакций его разложения. В конце процесса температура несколько повышается в связи с выделением тепла при начинающемся распаде ацетилена на углерод и водород.