Бутан, получение, свойства, химические реакции.
Бутан, C4H10 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Образуется также при крекинге нефтепродуктов.
Бутан, формула, газ, характеристики
Физические свойства бутана
Химические свойства бутана
Получение бутана
Химические реакции – уравнения получения бутана
Применение и использование бутана
Общая формула и изомерия
Одним из представителей алканов является изобутан. Формула данного класса имеет вид СпН2п+2. Молекула обладает линейной структурой, в который каждый углеродный атом находится в Sp3 гибридном состоянии. Наличие в молекуле одинарных (простых) связей объясняет сходство по химическим свойствам разветвленных алканов с веществами, имеющими прямой скелет.
Какие виды изомерии имеет изобутан? Формула этого вещества — С4Н10 или (CH3)3CH. Такой же молекулярный вид имеет нормальный бутан. Следовательно, для изобутана характерна изомерия углеродного скелета (структурный вид). Межклассовых изомеров для представителей предельных углеводородов не выявлено.
Бутан, формула, газ, характеристики:
Бутан – органическое вещество класса алканов, состоящий из четырех атомов углерода и десяти атомов водорода. Название происходит от корня «бут-» (французское название масляной кислоты – acide butyrique) и суффикса «-ан» (что означает принадлежность к алканам).
Химическая формула бутана C4H10. Имеет два изомера н-бутан и изобутан. В химии название «бутан» используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана.
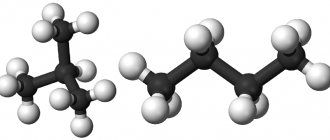
Рациональная формула н-бутана CH3-CH2-CH2-CH3, изобутана CH(CH3)3.
Строение молекулы н-бутана:
Строение молекулы изобутана:
Бутан – бесцветный газ, без вкуса, со специфическим характерным запахом.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов., в т.ч. сланцевой нефти.
Также содержится в сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Мало растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Малотоксичен, но оказывает вредное воздействие на человека – на нервную систему (отравление, рвота, возможен летальный исход), обладает наркотическими свойствами, может вызвать удушье и сердечную аритмию, вызывает дисфункцию лёгочно-дыхательного аппарата. Класс опасности четвертый.
Свойства и область применения изобутана
Определение 1
Изобутан – это углеводород, относящийся к классу алканов и представляющий собой изомер нормального бутана.
При нормальных условиях изобутан является газообразным веществом. Если происходит увеличение количества углеводородных атомов в молекуле, то происходит переход к жидкому агрегатному состоянию, а затем к твердому. Он обладает невысокой степенью растворимости в воде, но хорошо растворяется в органических соединениях.
Общая химическая формула изобутана выглядит следующим образом — $(CH_3)_3CH$. Таким образом, изобутан не способен вступать в реакции присоединения. Для класса алканов характерно радикальное замещение. Так как изобутан обладает подвижным углеродным атомом, то замещение происходит гораздо быстрее, чем у бутана, имеющего нормальное строение.
Ты эксперт в этой предметной области? Предлагаем стать автором Справочника Условия работы
Изобутан способен взаимодействовать с галогенами (бром, хром) под воздействием света. Это его свойство используется для получения одноатомных спиртов. Также изобутан востребован в качестве хладагента. Когда-то считалось, что изобутан оказывает негативное воздействие на озоновый слой, разрушая его целостность. Высокое октановое число изобутана делает возможным его использование в качестве специальной добавки к бензину. Он может применяться, как топливо для зажигалок, а также в парфюмерной промышленности и медицине. Изобутан также используется:
- При производстве вспененных полимерных материалов на основе полистирола, полиэтилена и т.п.
- При изготовлении монтажной пены.
- При производстве автомобильных эмалей, репеллентов, аэрозольных красок.
Физические свойства бутана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | специфический характерный запах |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 601,2 |
| Плотность (состояние вещества – газ, при 0 °C), кг/м3 | 2,672 |
| Температура плавления н-бутана, °C | -138,4 |
| Температура плавления изобутана, °C | -159,6 |
| Температура кипения н-бутана, °C | -0,5 |
| Температура кипения изобутана, °C | -11,7 |
| Температура самовоспламенения, °C | 372 |
| Критическая температура*, °C | 152,01 |
| Критическое давление, МПа | 3,797 |
| Критический удельный объём, м3/кг | 228 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 1,4 до 9,3 |
| Удельная теплота сгорания, МДж/кг | 45,8 |
| Молярная масса, г/моль | 58,12 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Сжиженный углеводородный газ (СУГ), сжиженный нефтяной газ (СНГ)
Сжиженный углеводородный газ (СУГ) является одним из видов альтернативного топлива.
СУГ — это смесь пропана, нормального бутана, изобутана, пропилена, этана, этилена и других углеводородов.
Способы получения СУГ:
- как продукт переработки нефти на нефтеперерабатывающих заводах (НПЗ),
- при добыче нефти и природного газа.
Использование смеси данных газов в качестве топлива обусловлено рядом физико-химических свойств:
- высокие температуры кипения при атмосферном давлении — позволяют хранить сжиженную пропан-бутановую смесь в диапазоне эксплуатационных температур: — 40°С — + 45°С при относительно низком давлении (до 1,6 МПа);
- СУГ не теряет и не изменяет своих свойств в течении долгого времени, не выветривается.
- октановое число СУГ — более благоприятно в сравнении с бензином и дизельным топливом и изменяется в интервале 90 -110, в зависимости от соотношения пропана и бутана в смеси.
- энергоэффективность СНГ ниже, чем у традиционных видов топлива из-за низкой энергии на ед. объема. Это повышает расход при сгорании на 10-20%, по сравнению с бензиновым топливом, но компенсируется в 2 раза меньшей ценой.
- СНГ сгорает более эффективно и безопасно даже в холодном двигателе, даже когда двигатель холодный, горит относительно чисто, без дыма и пепла, то есть более экологичен.
По сравнению с дизтопливом:
— 90 % меньше твердых частиц,
— 90 % меньше оксидов азота,
— 60 % меньше углекислого газа СО2,
— СНГ не загрязняет почву, потому что не растворяется в воде.
Каждый из компонентов газа имеет определенную температуру кипения, поэтому давление паровой фазы СУГ зависит как от температуры, так и от его компонентного состава.
Компонентный состав сжиженного углеводородного газа регламентируется ГОСТ 20448-90 «ГАЗЫ УГЛЕВОДОРОДНЫЕ СЖИЖЕННЫЕ ТОПЛИВНЫЕ ДЛЯ КОММУНАЛЬНО-БЫТОВОГО ПОТРЕБЛЕНИЯ».
Стандарт предусматривает 3 марки газа:
- ПТ (пропан технический),
- СПБТ (смесь пропана и бутана технических),
- БТ (бутан технический).
Содержание пропана, бутана и других примесей в СУГ влияет на многие его свойства, потому что значительно влияет на величину октанового числа и плотность паров топлива.
Октановое число (ОЧ) — показатель сопротивления топлива детонации:
- растет за счет увеличения содержания насыщенных углеводородов (пропана, н-бутана, изобутана и тд),
- ненасыщенные углеводороды полимеризуются, что способствует образованию осадка — нагара в баке, в топливной системе и камере сгорания.
Упругость паров (летучесть смеси) является очень важной в низких температурах окружающей среды. Удержание ее на соответствующем уровне дает возможность СНГ выйти из бака. Оба компонента смеси являются газообразными и низкокипящими.
Пропан кипит при атмосферном давлении уже при — 42 ° С, бутан, в тех же условиях температуры при -0,5 ° С, поэтому в зимний период содержание пропана в топливном газе увеличивают для роста упругости паров газа.
Летом соотношение смеси составляет около 40% пропана и 60% бутана, а зимой соотношение является противоположным: 60/40.
Пропан дороже бутана, поэтому «зимняя» смесь тоже дороже «летней».
На АГЗС должны следить за составом смеси и не хитрить, заменяя зимнюю смесь на летнюю.
В отличие от АГЗС, на АГНКС используется компримированный сетевой природный газ из газопроводов.
Технологии производства СУГ:
- непосредственно из сырой нефти: при добыче выделяется попутный нефтяной газ (ПНГ),
- при стабилизации в резервуарах выделяется этан, пропан, бутан и пентан.
Химические свойства бутана:
Бутан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства бутана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование бутана:
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, повышенная to).
- 2. галогенирование бутана:
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH2-CH3 + I2 → CH3-CHI-CH2-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы бутана, отрывая у них атом водорода, в результате этого образуется свободный бутил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH2-CH3 + Br· → CH3-CH·-CH2-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH2-CH3 + Br → CH3-CHBr-CH2-CH3 + Br·;
CH3-CH·-CH2-CH3 + Br· → CH3-CHBr-CH2-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование бутана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH2-CH3 + Br2 → CH3-CBr2-CH2-CH3 + HBr (hv или повышенная to);
и т.д.
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
- 3. нитрование бутана:
См. нитрование этана.
- 4. окисление (горение) бутана:
При избытке кислорода:
2C4H10 + 13O2 → 8CO2 + 10H2O.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод сажа (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование бутана:
C4H10 + SO2 + Cl2 → C4H9-SO2Cl + … (hv).
- 6. сульфоокисление бутана:
2C4H10 + 2SO2 + О2 → 2C4H9-SO2ОН (повышенная to).
Получение бутана. Химические реакции – уравнения получения бутана:
Так как бутан в достаточном количестве содержится в природном газе, попутном нефтяном газе и выделяется при крекинге нефтепродуктов, его не получают искусственно. Его выделяют при очистке и сепарации из природного газа, ПНГ и нефти при перегонке.
Бутан в лабораторных условиях получается в результате следующих химических реакций:
- 1. гидрирования непредельных углеводородов, например, бутена:
CH3-CH2-CH=CH2 + H2 → CH3-CH2-CH2-CH3 (kat = Ni, Pt или Pd, повышенная to).
- 2. восстановления галогеналканов:
C4H9I + HI → C4H10 + I2 (повышенная to);
C4H9Br + H2 → C4H10 + HBr.
- 3. взаимодействия галогеналканов с металлическим щелочным металлом, например, натрием (реакция Вюрца):
2C2H5Br + 2Na → CH3-CH2-CH2-CH3 + 2NaBr;
2C2H5Cl + 2Na → CH3-CH2-CH2-CH3 + 2NaCl.
Суть данной реакции в том, что две молекулы галогеналкана связываются в одну, реагируя с щелочным металлом.
- 4. щелочного плавления солей одноосновных органических кислот:
C4H9-COOH + NaOH → C4H10 + Na2CO3 (повышенная to);
C4H9-COONa + NaOH → C4H10 + NaHCO3.
Получение
Для лабораторного производства изобутана используют реакцию изомеризации углеводорода, имеющего неразветвленное строение. Для этого на соответствующий углеводород воздействуют активными металлами, выступающими в роли катализаторов. Таким способом в лаборатории получают и изобутан. Структурная формула данного соединения подтверждает разветвленность его строения.