Горение металлов
По характеру горения металлов их делят на две группы: летучие и нелетучие. Летучие металлы обладают относительно низкими температурами фазового перехода — температура плавления менее 1000 К, температура кипения не превышает 1500 К. К этой группе относятся щелочные металлы (литии, натрий, калий и др.) и щелочноземельные (магний, кальций). Температуры фазового перехода нелетучих металлов значительно выше. Температура плавления, как правило, выше 1000 К. а температура кипения — больше 2500 К (табл. 1).
Механизм горения металлов во многом определяется состоянием их окисла. Температура плавления летучих металлов значительно ниже температуры плавления их окислов. При этом последние представляют собой достаточно пористые образования.
При поднесении источника зажигания к поверхности металла происходит его испарение и окисление. При достижении концентрации паров, равной нижнему концентрационному пределу, происходит их воспламенение. Зона диффузионного горения устанавливается у поверхности, большая доля тепла перелается металлу, и он нагревается до температуры кипения. Образующиеся пары, свободно диффундируя через пористую окисную пленку, поступают в зону горения. Кипение металла вызывает периодическое разрушение окисной пленки, что интенсифицирует горение. Продукты горения (окислы металлов) диффундируют не только к поверхности металла, способствуя образованию корки окисла, но и в окружающее пространство, где, конденсируясь, образуют твердые частички в виде белого дыма. Образование белого плотного дыма является визуальным признаком горения летучих металлов.
У нелетучих металлов, обладающих высокими температурами фазового перехода, при горении на поверхности образуется весьма плотная окисная пленка, которая хорошо сцепляется с поверхностью металла. В результате этого скорость диффузии паров металла через пленку резко снижается и крупные частицы, например, алюминия и бериллия, гореть не способны. Как правило, пожары таких металлов имеют место в том случае, когда они находятся в виде стружки, порошков и аэрозолей. Их горение происходит без образования плотного дыма. Образование плотной окисной пленки на поверхности металла приводит к взрыву частицы. Это явление особенно часто наблюдается при движении частицы в высокотемпературной окислительной среде, связывают с накоплением паров металлов под окисной пленкой с последующим внезапным ее разрывом. Это, естественно, приводит к резкой интенсификации горения.
Основными параметрами их горения являются время воспламенения и сгорания. Из теории диффузионного горения следует, что время сгорания частицы металла tг пропорционально квадрату ее диаметра do. Экспериментальные данные показывают, что фактическая зависимость несколько отличается от теоретической. Так, для алюминия tг
Повышение концентрации кислорода в атмосфере интенсифицирует горение металла. Частички алюминия диаметром (53 ÷ 66) 10 -3 мм в атмосфере, содержащей 23% кислорода, сгорают за 12,7·10 -3 с, а при повышении концентрации окислителя до 60% — за 4,5·10 -3 с.
Однако для пожарно-технических расчетов большой интерес представляет не время сгорания частицы металла, а скорость распространения пламени по потоку взвеси частиц металла в окислителе. В табл.2 приведены экспериментальные данные по скорости распространения пламени и массовой скорости выгорания взвеси частиц диаметрами менее 10 -2 мм и 3·10 -2 мм алюминия в воздухе при различном коэффициенте избытка воздуха.
Алюминий при нагревании выделяет
Алюминий – горючий металл, атомная масса 26,98; плотность 2700 кг/м 3 , температура плавления 660,1 °С; температура кипения 2486 °С; теплота cгopания —31087 кДж/кг. Алюминиевая стружка и пыль могут загораться при местном действии малокалорийных источников зажигания (пламени спички, искры и др.).
При взаимодействии алюминиевого порошка, стружки, фольги с влагой образуется оксид алюминия и выделяется большое количество тепла, приводящее к их самовозгоранию при скоплении в кучах. Этому процессу способствует загрязненность указанных материалов маслами. Выделение свободного водорода при взаимодействии алюминиевой пыли с влагой облегчает ее взрыв.
Температура самовоспламенения образца алюминиевой пыли дисперсностью 27 мкм 520 °С; температура тления 410 °С; нижний концентрационный предел распространения пламени 40 г/м 3 ; максимальное давление взрыва 1,3 МПа; скорость нарастания давления: средняя 24,1 МПа/с, максимальна 68,6 МПа/с.
Предельная концентрация кислорода, при которой исключается воспламенение аэровзвеси электрической искрой, 3% объема. Осевшая пыль пожароопасна. Температура самовоспламенения 320 °С. Алюминий легко взаимодействует при комнатной температуре с водными растворами щелочей и аммиака с выделением водорода.
Смешивание алюминиевого порошка с щелочным водным раствором может привести к взрыву. Энергично реагирует со многими металлоидами. Алюминиевая стружка горит, например, в броме, образуя бромид алюминия. Взаимодействие алюминия с хлором и бромом происходит при комнатной температуре, с йодом — при нагревании. При нагревании алюминий соединяется с серой.
Если в пары кипящей серы всыпать порошок алюминия, то алюминий загорается. Сильно измельченный алюминий вступает в реакцию с галоидированными углеводородами; присутствующий в небольшом количестве хлорид алюминия (образующийся в процессе этой реакции) действует как катализатор, ускоряя реакцию, в ряде случаев приводящую к взрыву.
Такое явление наблюдается при нагревании порошка алюминия с хлористым метилом, четыреххлористым углеродом, смесью хлороформа и четыреххлористого углерода до температуры около 150 °С.
Алюминий в виде компактного материала не взаимодействует с четыреххлористым углеродом. Смешивание алюминиевой пыли с некоторыми хлорированными углеводородами и спиртом приводит к самовозгоранию смеси.
Смесь алюминиевого порошка с оксидом меди, оксидом серебра, оксидом свинца и особенно диоксидом свинца горит со взрывом. Смесь нитрата аммония, алюминиевого порошка с углем или нитросоединениями — взрывчатое вещество.
Средства тушения: сухой песок, глинозем, магнезитовый порошок, асбестовое одеяло. Применять воду и огнетушители запрещается.
В чистом виде алюминий в природе не встречается, потому что очень быстро окисляется кислородом воздуха с образованием прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
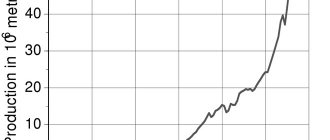
Алюминий и его сплавы являются наиболее распространенными среди цветных металлов материалами и находят все более широкое применение в транспорте, строительстве, упаковке, электротехнике и производстве предметов быта. Благодаря уникальному комплексу свойств они успешно выдерживают конкуренцию со стороны других конструкционных материалов, таких как сталь, бетон, дерево, пластмассы, стекло и др.
К сожалению, в России — одном из крупнейших мировых производителей первичного алюминия — использование алюминия для этих целей существенно отстает от уровня развитых стран. Из произведенного в прошлом году 3,76 млн. т алюминия только немногим более 600 тыс. т было использовано в виде изделий для внутреннего потребления в стране. Причин этому несколько.
В первую очередь низкий спрос на алюминиевую продукцию в России обусловлен значительным спадом промышленного производства.
Однако немаловажную роль сыграло имевшее в советское время подчинение потребления нуждам военно-промышленного комплекса и, как следствие, недостаточная до настоящего времени осведомленность производителей и потребителей гражданской промышленной продукции о свойствах алюминия, его сплавов и их преимуществах перед другими материалами.
Отсюда и ошибочные представления у многих, например, о токсичности или излишне высокой стоимости алюминия, невысокой коррозионной стойкости или недостаточной механической прочности его сплавов и др. А эти стереотипы создают препятствие применению алюминия в изделиях, сооружениях и машинах.
С очередным мифом мы столкнулись, знакомясь с материалами «круглого стола» по проблеме «Вентилируемые фасады: «за» или «против» [1]. В ходе дискуссии там были высказаны опасения в части применения для этих целей алюминия: мол «…алюминиево-магниевые сплавы горят… и специалисты-материаловеды, работающие в авиации, это прекрасно знают…».
Наш почти сорокалетний опыт работы в авиационной промышленности, связанный с плавлением, литьем и горячей обработкой давлением практически всех марок алюминиевых деформируемых сплавов позволяет судить об ошибочности этого утверждения.
Известно, что горение — это высокотемпературное окисление, характеризующееся высокой скоростью процесса и выделением значительного количества тепла. Поэтому представления о горючести алюминия и его сплавов прежде всего связаны с большим сродством алюминия к кислороду. Из рис.
1 [2]следует, что алюминий отличается от меди и железа значительно более высокой теплотой окисления. Его окисел очень стабилен и плохо восстанавливается. Это свойство широко используется в металлургии, где алюминий применяют в качестве раскислителя.
Отметим, что разница в сродстве к кислороду предопределила хронологию применения этих металлов человечеством.
В бронзовом веке сначала использовали самородную медь, а затем стали получать ее сплавы с оловом, раздувая горн легкими через трубки. Для получения железа потребовалось уже восстановление руды древесным углем в сыродутных печах.
И только с появлением электричества стало возможным разорвать прочную связь кислорода и алюминия и начать производство этого легкого металла.
Известно, что при нагреве мелко раздробленного алюминия он энергично сгорает на воздухе
При этом выделяется 31 кДж энергии на 1 г окислившегося алюминия, это чуть меньше тепла, образуемого при сгорании 1 л природного газа. Чем дисперснее частицы алюминия, тем меньшая необходима температура нагрева.
Так, алюминиевый порошок, смешанный с выделяющими кислород веществами, начинает интенсивно гореть при температуре воспламенения 250–300 0С. Это широко используется в пиротехнике и производстве ракетного топлива.
Распыленный же в воздухе алюминиевый порошок с размерами частиц менее 100 мкм способен образовывать взрывчатую смесь при комнатной температуре.
Горение – алюминий
Массовая скорость испарения пггф материала в режиме кипения определяется скоростью поступления тепла из зоны горения, которая пропорциональна разности температур горения Тг и кипения Тк. Поскольку Тт в рассматриваемой области давлений почти не изменяется, а Тк увеличивается с увеличением давления, то разность Тг-Тк уменьшается с ростом давления и вместе с этим уменьшается скорость газификации ( испарения) металла тгф а ( Тг-ТК) / ЬИСЯ. Таким образом, при увеличении давления происходит приближение зоны горения к поверхности металла и парофазное горение может прекратиться. Следовательно, при горении алюминия существует область давлений, в которой механизм горения алюминия контролируется скоростью его испарения, и в этой области происходит постепенный переход от парофазного горения при наличии кипения к горению в отсутствие кипения, при котором могут преобладать реакции на поверхности металла. [31]
Близкая к этому значению температура горения алюминия приводится в работах [ 11, с. Температуре 3533 К по формуле (1.15), описывающей кривую кипения, соответствует давление р 3 22 МПа. Отсюда ясно, что при давлениях, больших 3 22 МПа. [33]
Алюминий и его реакция с водой
Почему алюминий устойчив к коррозии
Впервые алюминий был получен лишь в начале XIX века. Cделал это физик Ганс Эрстед. Свой эксперимент он проводил с амальгамой калия, хлоридом алюминия и ртутью.
Кстати, название этого серебристого материала произошло от латинского слова «квасцы», потому что именно из них добывается этот элемент.
Квасцы – это природные минералы на основе металлов, которые объединяют в своем составе соли серной кислоты.
Раньше алюминий считался драгоценным металлом и стоил на порядок дороже, чем золото. Объяснялось это тем, что металл было довольно сложно отделить от примесей. Так что позволить себе украшения из алюминия могли только богатые и влиятельные люди.
Но в 1886 году Чарльз Холл придумал метод по добыче алюминия в промышленном масштабе, что резко удешевило этот металл и позволило применять его в металлургическом производстве. Промышленный метод заключался в электролизе расплава криолита, в котором растворен оксид алюминия.
Пожары класса D: горят ли металлы?
Фраза «горение металлов» у многих вызывает недоумение. Люди далекие от вопросов пожарной безопасности уверены, что металлы не горят. Однако это не совсем так. Некоторые металлы способны не просто гореть, но даже самовоспламеняться.
Основные опасности, которые несут в себе разные металлы:
- Алюминий – легкий электропроводный металл с довольно низкой температурой плавления (660°С), в связи с чем при пожаре может произойти разрушение алюминиевых конструкций. Но самым опасным является алюминиевый порошок, который несет в себе угрозу взрыва и может гореть.
- Кадмий и многие другие металлы под воздействием высоких температур выделяют токсичные пары. Поэтому тушение горящих металлов следует производить в защитных масках.
- Щелочные металлы (натрий, калий, литий) вступают в реакцию с водой, образуя при этом водород и количество теплоты, необходимой для его воспламенения.
- Чугун в виде порошка при воздействии высоких температур или огня может взорваться. Искры от чугуна могут спровоцировать возгорание горючих материалов, находящихся вблизи.
- Сталь, которая не считается горючим металлом, также может загореться, если она находится в порошкообразном состоянии или в виде опилок.
- Титан – прочный металл, основной элемент стальных сплавов. Плавится он при высоких температурах (2000°С) и в больших конструкциях или изделиях не горит. Но маленькие детали из титана вполне могут воспламениться.
- Магний – один из главных элементов в легких сплавах, придающий им пластичность и прочность. Гореть могут хлопья и порошок магния. Твердый магний также может воспламениться, но только если его нагреть до температуры выше 650°С.
Как видно, гореть способны в основном измельченные металлы в виде порошка, стружки, опилок. Помимо указанных опасностей, металлы могут также стать причиной травм, ожогов и увечий людей.
Тушение пожаров класса D
Горение класса D происходит на поверхности металла при очень высокой температуре и сильным искрообразованием.
Вода как огнетушащее вещество совершенно не подходит для металлических изделий и порошков, так как многие из них вступают в реакцию с ней, вследствие чего пожар может только усилиться. Также попадание воды на горящий металл может способствовать разбрызгиванию его на людей и окружающие предметы.
Песком также нельзя тушить горящие металлы. Его применение может привести к взаимодействию этих двух материалов и усилить горение.
Для тушения металлов чаще всего используют специальные сухие порошки. Причем для каждого метала необходимо подбирать свой состав.
Горение магния и сплавов на его основе подавляется посредством сухих молотых флюсов, применяемых при их плавке. Флюсы способствуют отделению очага возгорания от воздуха с помощью образующейся жидкой пленки.
Оксид алюминия: получение и свойства
Оксид алюминия
Способы получения
Оксид алюминия можно получить различными методами :
1. Горением алюминия на воздухе:
2. Разложением гидроксида алюминия при нагревании :
3. Оксид алюминия можно получить разложением нитрата алюминия :
Химические свойства
Оксид алюминия — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например , оксид алюминия взаимодействует с оксидом натрия:
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом оксид алюминия проявляет кислотные свойства.
Например , оксид алюминия взаимодействует с гидроксидом натрия
в расплаве с образованием
алюмината натрия и воды:
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например , оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например , оксид алюминия реагирует с серной кислотой:
6. Оксид алюминия проявляет слабые окислительные свойства .
Например , оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Источник
Классификация
Большинство продуктов горения являются отравляющими веществами. Поэтому, говоря об их классификации, будет правильным ознакомить вас со следующим термином:
Классификация опасности веществ по степени воздействия на организм – это установление (ранжирование) уровней опасности веществ по их поражающему и повреждающему воздействию на организм человека и (или) животного. Более подробно о данной классификации читайте в материале по ссылке >>
Также ознакомьтесь с познавательным материалом по теме:
Формулы для расчета объема
Вид формулы для расчета объема продуктов полного сгорания при теоретически необходимом количестве воздуха зависит от состава горючего вещества.
Индивидуальное химическое соединение
В этом случае расчет ведут, исходя из уравнения реакции горения. Объем влажных продуктов сгорания единицы массы (кг) горючего вещества при нормальных условиях рассчитывают по формуле:
Vп.с. – объем влажных продуктов сгорания, м 3 /кг;
– число киломолей диоксида углерода, паров воды, азота и горючего вещества в уравнении реакции горения;
М
– масса горючего вещества, численно равная молекулярной массе, кг.
Например, чтобы определить объем сухих продуктов сгорания 1 кг ацетона при нормальных условиях, составляем уравнение реакции горения ацетона в воздухе:
Определяем объем сухих продуктов сгорания ацетона:
Объем влажных продуктов сгорания 1 м 3 горючего вещества (газа) можно рассчитать по формуле:
Vп.с. – объем влажных продуктов сгорания 1 м 3 горючего газа, м 3 /м 3 ;
– число молей диоксида углерода, паров воды, азота и горючего вещества (газа).
Сложная смесь химических соединений
Если известен элементный состав сложного горючего вещества, то состав и количество продуктов сгорания 1 кг вещества можно определить по уравнению реакции горения отдельных элементов. Для этого составляют уравнения реакции горения углерода, водорода, серы и определяют объем продуктов сгорания, приходящийся на 1 кг горючего вещества. Уравнение реакции горения имеет вид:
С + О 2 + 3,76N 2 = СО 2 + 3,76N 2
При сгорании 1 кг углерода получается 22,4 / 12 = 1,86 м 3 СО 2 и 22,4 × 3,76/12 = 7,0 м 3 N 2.
Аналогично определяют объем (в м 3 ) продуктов сгорания 1 кг серы и водорода. Полученные данные приведены ниже:
При горении углерода, водорода и серы кислород поступает из воздуха. Однако в состав горючего вещества может входить кислород, который также принимает участие в горении. В этом случае воздуха на горение вещества расходуется соответственно меньше.
В составе горючего вещества могут находиться азот и влага, которые в процессе горения переходят в продукты сгорания. Для их учета необходимо знать объем 1 кг азота и паров воды при нормальных условиях.
Объем 1 кг азота равен 0,8 м 3 , а паров воды 1,24 м 3 . В воздухе при 0 °С и давлении 101325 Па на 1 кг кислорода приходится 3,76 × 22,4 / 32 = 2,63 м 3 азота.
На основании приведенных данных определяют состав и объем продуктов сгорания 1 кг горючего вещества.
Например, чтобы определить объем и состав влажных продуктов сгорания 1 кг каменного угля, состоящего из 75,8 % С, 3,8 % Н, 2,8 % О, 1,1 % N, 2,5 % S, W = 3,8 %, A = 11,0 %.
Объем продуктов сгорания будет следующий, м 3 :
| Состав продуктов сгорания | СО2 | Н2О | N2 | SO2 |
| Углерод | 1,86 × 0,758 = 1,4 | – | 7 × 0,758 = 5,306 | – |
| Водород | – | 11,2 × 0,038 = 0,425 | 21 × 0,038 = 0,798 | – |
| Сера | – | – | 2,63 × 0,025 = 0,658 | 0,7 × 0,025 = 0,017 |
| Азот в горючем веществе | – | – | 0,8 × 0,011 = 0,0088 | – |
| Влага в горючем веществе | – | 1,24 × 0,03 = 0,037 | – | – |
| Сумма | 1,4 | 0,462 | 6,7708 – 0,0736 = 6,6972 | 0,017 |
Из общего объема азота вычитают объем азота, приходящийся на кислород в составе каменного угля 0,028 × 2,63 = 0,0736 м 3 . Итог указывает состав продуктов сгорания каменного угля: объем влажных продуктов сгорания 1 кг каменного угля равен:
Vп.с. = 1,4 + 0,462 + 6,6972 + 0,017 = 8,576 м 3 /кг.
Смесь газов
Количество и состав продуктов сгорания для смеси газов определяют по уравнению реакции горения компонентов, составляющих смесь. Например, горение метана протекает по следующему уравнению:
СН 4 + 2О 2 + 2 × 3,76N 2 = СО 2 + 2Н 2О + 7,52N 2
Действие на организм человека
Степень токсичности веществ связана с их физической и химической природой. Взаимодействуя с организмом, продукты горения вызывают патологические синдромы.
Международная классификация болезней десятого пересмотра МКБ-10 определяет отравление продуктами горения кодом Т59 – «Токсическое действие других газов, дымов и паров».
По механизму действия на человека отравляющие компоненты в составе дыма делятся на пять групп.
- Вещества, которые вызывают поражение кожного покрова и слизистой оболочки. Симптомы такого отравления продуктами горения – зуд, жжение кожи и её воспаление, боль в области глаз, век, слезотечение, кашель. Примеры – пары дёгтя, сернистый газ, формальдегид.
- Продукты горения, которые вызывают острые ингаляционные отравления. Пострадавшие жалуются на одышку, кашель. При осмотре обращает на себя внимание частое дыхание, синюшность. При высокой концентрации токсичного газа может произойти остановка дыхания. Так, признаки отравления продуктами горения ПВХ могут проявиться через несколько часов. Ингаляционные отравления вызывает хлор, аммиак, оксид азота.
- Продукты горения с образованием токсичных веществ, которых называют «ядами крови». Связывая гемоглобин, они нарушают доступ кислорода к тканям и запускают патологические реакции, охватывающие весь организм. Примеры – угарный газ, диоксид азота.
- Продукты горения, для которых органом-мишенью является нервная система. Это бензол, сероводород.
- Ферментные яды, которые воздействуют на тканевое дыхание, блокируя процессы активации кислорода. Это сероводород, синильная кислота.
Многие токсины, образующие в продуктах горения «универсальны», так как вызывают поражение сразу нескольких систем организма.